
分析 (1)在水溶液里或熔融状态下能导电的化合物是电解质,在溶液里全部电离的电解质是强电解质;
(2)氟化氢在溶液中部分电离出氢离子和氟离子;
(3)氢氧化铁为弱碱,在溶液中部分电离出铁离子和氢氧根离子;
(4)NaHSO4在熔融状态下电离出钠离子和硫酸氢根离子;
(5)酸性高锰酸钾溶液具有强氧化性,能够将醋酸氧化成二氧化碳气体和水.
解答 解:(1)在溶液里全部电离的电解质是强电解质,6种物质中能够在溶液中完全电离的电解质有:①干燥的食盐晶体 ②液态氯化氢,
故答案为:①②;
(2)HF为弱电解质,在溶液中部分电离,其电离方程式为:HF?H++F-或HF+H2O?H3O++F-,
故答案为:HF?H++F-或HF+H2O?H3O++F-;
(3)Fe(OH)3为弱碱,存在电离平衡,则氢氧化铁水中的电离方程式为:Fe(OH)3?Fe3++3OH-,
故答案为:Fe(OH)3?Fe3++3OH-;
(4)NaHSO4在熔融状态下完全电离出钠离子和硫酸氢根离子,其电离方程式为:NaHSO4═Na++HSO4-,
故答案为:NaHSO4═Na++HSO4-;
(5)草酸(H2C2O4)和酸性高锰酸溶液发生氧化还原反应,反应的离子反应方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
点评 本题考查较为综合,涉及离子方程式、电离方程式、强弱电解质的判断等知识,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握强弱电解质的概念,试题培养了学生的灵活应用能力.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:实验题
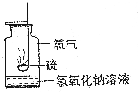 郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.
郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
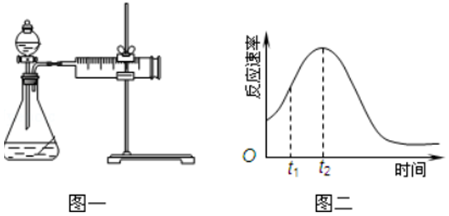
| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
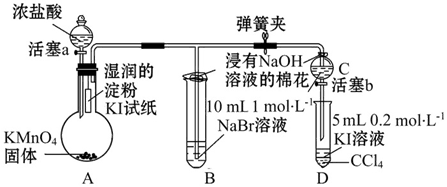
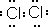 ,在该反应中浓盐酸表现了还原性和酸性.
,在该反应中浓盐酸表现了还原性和酸性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
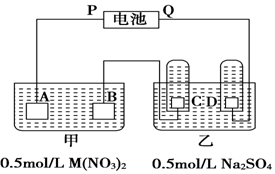
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com