
【题目】在容积固定的密闭容器中发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是
A.从700 ℃到900 ℃,平衡体系中气体的密度变大
B.该反应的化学平衡常数表达式为K=![]()
C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D.该反应的正反应是放热反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题: 
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl
①该电池的负极反应式是;
②在电池中,Na+不断移动到“水”电池的极(填“正”或“负”);
③外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是 .
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破.甲醇燃料电池的工作原理如图所示.
①该电池工作时,b口通入的物质为 .
②该电池负极的电极反应式 .
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,有NA个电子转移.
(3)Ag2O2是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4 , 写出该电池反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在水溶液中大量共存的一组离子是
A.H+、I-、NO3-、CO32-B.NH4+、Fe3+、OH-、Br-
C.K+、Cl-、Cu2+、NO3-D.Al3+、SO42-、Na+、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014-2015成都双流中学高三下第一次月考】根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是( )

选项 | 实验 | 实验现象 | 结论 |
A | a | 左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl < AgBr < Ag2S |
D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,下列关于水的说法正确的是
A.水是非电解质
B.pH=6.8的纯水呈中性
C.降低温度,水的Kw增大
D.电解水制氢气和氧气时可向其中加入盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计方案不正确的是
A. 分离碘和CCl4的混合物:用分液漏斗分液
B. 区分NaCl和KCl溶液:焰色反应
C. 除去乙醇中混有的少量水:加入生石灰蒸馏
D. 检验某未知溶液中的SO42—:加入稀硝酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH(氢化锂)常用作干燥剂、氢气发生剂等,可利用下列反应制备:2Li(熔融)+H2 ![]() 2LiH.有关说法不正确的是( )
2LiH.有关说法不正确的是( )
A.微粒半径:r(H﹣)>r(H+)
B.H﹣与Li+电子层结构相同
C.还原性:H>Li
D.碱性:LiOH<NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列化合物:①硝基苯 ②环己烷 ③乙苯 ④溴苯 ⑤间二硝基苯.其中能由苯通过一步反应直接制取的是( )
A. ①②③ B. ①③⑤ C. ①②④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
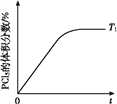
【题目】五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:
PCl3(g)+Cl2(g)![]() PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~150 s内的平均反应速率v(PCl3)=________mol·L-1·s-1。
(2)该温度下,此反应的化学平衡常数的数值为____(可用分数表示)。
(3)反应至250 s时,该反应放出的热量为________kJ。
(4)下列关于上述反应的说法中,正确的是______(填字母)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300 s时,升高温度,正、逆反应速率同时增大
c.350 s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0 mol PCl3和0.2 mol Cl2,达到化学平衡状态时,n(PCl5)<0.20 mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如上。其他条件相同,请在上图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com