
| A�� | �����£�Ag2SO4��AgCl��AgI��ˮ���ܽ��������μ��� | |
| B�� | ��AgCl������Һ�м���NaI���壬��AgI�������� | |
| C�� | ��AgCl������Һ�м���NaI���壬��AgI�������� | |
| D�� | ��ΪAgCl��Ag2SO4�����ܣ�����AgCl����ת��ΪAg2SO4 |
���� A������Ag2SO4��AgCl��AgI��Ksp���㣻
B����ѧʽ���Ƶ��ܶȻ�ԽС��Խ���ܣ�
C����ѧʽ���Ƶ��ܶȻ�ԽС��Խ���ܣ�
D������Һ��Qc��Ag2SO4����Ksp��Ag2SO4��ʱ��������Ag2SO4������
��� �⣺A����Ag2SO4������Һ�У�Ksp��Ag2SO4��=1.4��10-5 mol3•L-3=$\frac{1}{2}$c3��Ag+�������c��Ag+��=3.04��10-2mol/L��
��AgCl������Һ�У�Ksp��AgCl��=1.8��10-10 mol2•L-2=c��Ag+��•c��Cl-��=c2��Ag+�������c��Ag+����1.34��10-5mol/L
��AgI������Һ�У�Ksp��AgI��=8.3��10-17mol2/L-2=c��Ag+��•c��I-��=c2��Ag+�������c��Ag+����9��10-8mol/L�����Գ����£�Ag2SO4��AgCl��AgI��ˮ���ܽ��������μ�С����A��ȷ��
B��AgCl��AgI���ܶȻ�������˵��AgI���ܣ���AgCl������Һ�м���NaI���壬��AgI�������ɣ���B��ȷ��
C��AgCl��AgI���ܶȻ�������˵��AgI���ܣ���AgCl������Һ�м���NaI���壬��AgI�������ɣ���C��ȷ��
D��AgCl��Һ�м�һ������Na2SO4������Һ��Qc��Ag2SO4����Ksp��Ag2SO4��ʱ��������Ag2SO4������������һ�������£�AgCl��ת��ΪAg2SO4����D����
��ѡD��
���� ���⿼�����ܵ���ʵ��ܽ�ƽ�⼰����ת���ı��ʣ���Ŀ�Ѷ��еȣ�����ע���ܶȻ����������ú����⣬�����ڿ���ѧ���ķ��������ͼ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.12L | B�� | 2.24L | C�� | 3.36L | D�� | 4.48L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ŷź�ˮ�ĸ����������õ�������һ��ʯī��һͬ���뺣ˮ�� | |
| B�� | �ں�����������˿ϵסп����ں�ˮ�� | |
| C�� | �������Ƴɷ���ʴ�ĺϽ��粻��� | |
| D�� | �ڵ������͵��������Ͻ�ֱ����Դ�ĸ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ��ʹ��ɫʯ����Һ��� | |
| B�� | ������Һ����̼���Ʒ�Ӧ����������̼���� | |
| C�� | ��д�����Һ����ȴ�����£�������ҺpH��� | |
| D�� | Ũ�Ⱦ�Ϊ1mol/L������ʹ��ᣬǰ�ߵ�������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
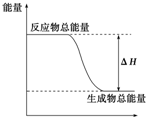
| A�� | ���ȷ�Ӧ | B�� | ���ȵ�̿�������̼��Ӧ | ||
| C�� | Ba��OH��2•8H2O�����NH4Cl������ | D�� | ̼��Ƶķֽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2 | B�� | CH3CH3 | C�� | NaCl | D�� | N2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com