
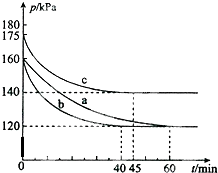
 在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )
在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )| A. | 与实验a相比,实验b升高了温度,实验c加入了催化剂 | |
| B. | 从反应开始至刚达平衡时,实验b的化学反应速率ν(PCl5)=5×10-4mol/(L.min) | |
| C. | 实验c达平衡时,PCl3(g)的转化率为 60% | |
| D. | 在实验a条件下,该反应的平衡常数K=100 |
分析 气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算,设得到平衡状态时消耗PCl3物质的量为x,
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
A.分析图象可知达到平衡状态的时间不同,时间越短反应速率越快;其中b和a达到相同平衡状态,但时间不同,说明b是加入了催化剂改变了反应速率;c混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大;
B.图象分析可知实验b气体压强160变化为120,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,则x=0.1mol,然后依据化学反应速率概念计算;
C.根据平衡时实验c的压强计算出转化的物质的量,然后计算出转化率;
D.ab是相同平衡状态,平衡时阿玉b的各组分的浓度相同,先计算出各组分浓度,然后根据平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$计算.
解答 解:恒温恒容条件下,气体压强之比等于气体物质的量之比,设得到平衡状态时消耗PCl3物质的量为x,
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
A.分析图象可知达到平衡状态的时间不同,时间越短反应速率越快,图中3组实验从反应开始至达到平衡时的反应速率v(PCl3)由大到小的次序b>c>a,与实验a相比,b和a达到相同平衡状态,但时间不同,b组改变的实验条件及判断依据是加入了催化剂改变了反应速率;c混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大,故A错误;
B.图象分析可知实验b气体压强160变化为120,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,解得:x=0.1mol,则实验b从反应开始至达到平衡时的反应速率为:v(PCl5)=$\frac{△c}{△t}$=$\frac{\frac{0.1mol}{10L}}{60min}$=1.7×10-4mol/L•min,故B错误;
C.图象分析可知实验c平衡时气体压强175变化为140,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=175:140,解得:x=0.08mol,则实验c达平衡时,PCl3(g)的转化率为:$\frac{0.08mol}{0.2mol}$×100%=40%,故C错误;
D.ab是相同平衡状态,平衡时各组分的浓度相同,图象分析可知实验a气体压强160变化为120,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,解得:x=0.1mol,平衡浓度分别为:c( PCl3)=0.01mol/L,c(Cl2)=0.01mol/L,c(PCl5)=0.01mol/L,所以实验a条件下的平衡常数K=$\frac{0.01}{0.01×0.01}$=100,故D正确;
故选D.
点评 本题考查了化学平衡的图象及计算,题目难度中等,明确恒温恒容条件下气体物质的量与压强之间的关系为解答关键,注意掌握化学平衡状态特征及应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| B. | 淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物 | |
| C. | 在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解 | |
| D. | 北京奥运吉祥物“福娃”的材质是PVC(聚氯乙烯),其单体的结构是CH2=CHCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
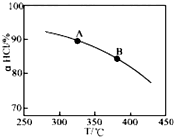 用O2将HCl转化为Cl2,可提高效益,减少污染,
用O2将HCl转化为Cl2,可提高效益,减少污染,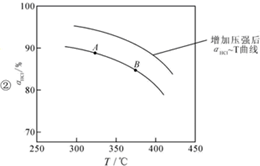 增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.
增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3COO-)<c(Na+) | B. | c(CH3COOH)>c(CH3COO-) | ||
| C. | 2c(H+)=c(CH3COO-)-c(CH3COOH) | D. | c(CH3COOH)+c(CH3COO-)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合后的溶液 | 加入的酸 | 酸的浓度/(mol•L-1) | 混合后溶液的pH |
| ① | HA | 0.10 | 8.7 |
| ② | HB | 0.12 | 2 |
| A. | HA是强酸,HB是弱酸 | |
| B. | 升高温度,溶液②中$\frac{c({B}^{-})}{c(N{a}^{+})}$增大 | |
| C. | 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
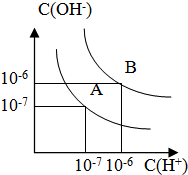 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度(mol• L-1) | NaOH物质的 量浓度(mol• L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
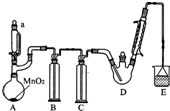 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com