
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O=CH3COO-+Al(OH)3↓ | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+=2Fe2++S↓ |
分析 A.反应生成氢氧化铜、硫酸钠和氢气;
B.溶液由红色变成无色,反应生成硫酸钡、硫酸钠和水;
C.反应生成氢氧化铝和醋酸钠;
D.发生氧化还原反应生成FeS和S.
解答 解:A.将钠粒投入CuSO4溶液中的离子反应为2H2O+2Na+Cu2+=Cu(OH)2↓+H2↑+2Na+,故A错误;
B.NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B错误;
C.将少量醋酸加入到NaAlO2溶液中的离子反应为CH3COOH+AlO2-+H2O=CH3COO-+Al(OH)3↓,故C正确;
D.硫化钠溶液中加入少量的氯化铁溶液的离子反应为3S2-+2Fe3+=2FeS+S↓,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸都可以与钠反应生成氢气 | |
| B. | 油脂、淀粉、纤维素都属于天然高分子化合物 | |
| C. | 甲苯和乙烯都可与溴水发生化学反应造成溴水褪色 | |
| D. | 蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
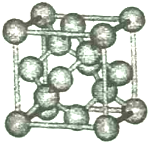 2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:
2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
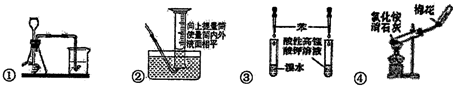
| A. | ①检查装置气密性 | B. | ②读取气体体积 | ||
| C. | ③验证苯中是否有碳碳双键 | D. | ④实验室制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 是制作电木的原料.下列围绕此物质的讨论正确的是( )
是制作电木的原料.下列围绕此物质的讨论正确的是( )| A. | 该有机物没有确定的熔点 | B. | 该有机物通过加聚反应得到 | ||
| C. | 该有机物通过苯酚和甲醇反应得到 | D. | 该有机物的单体是-C6H3OHCH2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. (其中一种).
(其中一种). )的合成路线.
)的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只验证它完全燃烧后的产物只有H2O和CO2 | |
| B. | 只测定其燃烧产物中H2O和CO2的物质的量的比值 | |
| C. | 测定完全燃烧时消耗的有机物与生成的CO2、H2O的物质的量之比 | |
| D. | 测定该试样的质量及其试样完全燃烧后只生成CO2和H2O并测定CO2和H2O的质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com