
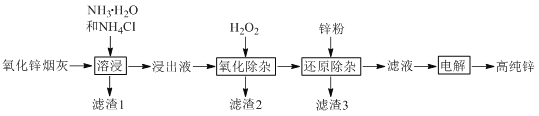
����Ŀ�������ܽ�����п�̻���ȡ�ߴ�п�Ĺ���������ͼ��ʾ���ܽ�������п�̻���п��ͭ���ӡ���Ԫ�طֱ���Zn(NH3)42+��Cu(NH3)42+��Cd(NH3)42+��AsCl52������ʽ���ڡ�
�ش��������⣺
��1��Zn(NH3)42+��Zn�Ļ��ϼ�Ϊ________�����ܽ�����ZnO������Ӧ�����ӷ���ʽΪ________��
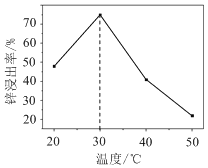
��2��п���������¶ȵĹ�ϵ��ͼ��ʾ������30 ��ʱп��������ߵ�ԭ��Ϊ________��
��3�����������ӡ��У�AsCl52��ת��ΪAs2O5���������۳���ȥ����Һʼ�սӽ����ԡ��÷�Ӧ�����ӷ���ʽΪ________��
��4��������3������Ҫ�ɷ�Ϊ________��
��5������⡱ʱZn(NH3)42+�������ŵ�ĵ缫��ӦʽΪ_______���������ų�һ����ɫ��ζ�����壬����ͨ�����KSCN��FeCl2��Һ�У�����������������________��д��ѧʽ��������ĵ��Һ������________��дһ�����ʵĻ�ѧʽ����ɷ��ء��ܽ����������ʹ�á�
���𰸡��������1��+2 �������2��ZnO+2NH3��H2O+2NH4+=Zn(NH3)42++3H2O ����30��ʱ���ܽ���Ӧ�������¶����߶�������30�棬�����ݳ������ܽ���Ӧ�����½� �������4��2AsCl52-+2H2O2+6NH3��H2O=As2O5+10Cl-+6NH4++5H2O �������5��Cu��Cd �������6��Zn(NH3)42++2e-=Zn+4NH3�� �������7��N2 �������8��NH3(��NH3��H2O)
��������
(1) NH3�����Է��ӣ�����Zn(NH3)42+���Ӵ���2����λ������ɣ�˵������Zn����2����λ������ɣ���Zn�Ļ��ϼ�Ϊ+2�ۣ�NH4+ˮ��ʹ��Һ�����ԣ�ZnO��H+��Ӧ��ΪZn2+��Zn2+��NH3��H2O��Ӧ����Zn(NH3)42+����Ӧ���ܵ����ӷ���ʽΪ��ZnO+2NH3��H2O+2NH4+=Zn(NH3)42++3H2O��
(2)��п���������¶ȵĹ�ϵͼ��֪�����¶ȵ���30 ��ʱ���¶����ߣ���Ӧ�������¶����߶������¶ȳ���30����NH3��H2O�ֽ���������������ݳ������ܽ���Ӧ�����½�����30 ��ʱп��������ߣ�
(3)���������������У�H2O2��AsCl52��������ת��ΪAs2O5���壬�������۳���ȥ��H2O2����ԭ��ΪH2O����Ӧ����Һʼ�սӽ����ԡ���÷�Ӧ�����ӷ���ʽΪ2AsCl52-+2H2O2+6 NH3��H2O=As2O5+10Cl-+6 NH4++5H2O��
(4) �����������������Һ�к�Zn(NH3)42+��Cu(NH3)42+��Cd(NH3)42+�������Һ�м���Zn�ۣ�Zn��Cu2+��Cd2+��ԭΪ�������ʣ�����������3������Ҫ�ɷ�ΪCu��Cd��
(5)�������ʱZn(NH3)42+�������ŵ磬�缫��ӦʽΪZn(NH3)42++2e-=Zn+4NH3���������������ӷŵ磬�ų�һ����ɫ��ζ�����壬����ͨ�����KSCN��FeCl2��Һ�У�����������˵�������岻���������ԣ����������N2���������Һ������NH3���Ϸŵ����N2����Һ���ݳ������Ե���ĵ��Һ������NH3��NH3��H2O�Ժ�ſɷ������ܽ����������ʹ�á�


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��R����ۺ��������ʽΪHnRO2n-2��������̬�⻯���У�RԪ�صĻ��ϼ�Ϊ�� ��
A.3n��12B.3n��6
C.3n��4D.2n��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���6.72L NH3 ��1.204��1023��H2S ��5.6g CH4 ��0.5mol HCl �����й�ϵ��ȷ���ǣ� ��
A. �����С���ܣ��ۣ��ڣ���B. ԭ����Ŀ���ۣ��٣��ڣ���
C. �ܶȴ�С���ܣ��ڣ��ۣ���D. ������С���ܣ��ڣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������㷺Ӧ������ҩ�ͻ�����ҵ��ijͬѧ�����üױ���������Ӧ�Ʊ������ᡣ��Ӧԭ����

��֪���ױ����۵�Ϊ-95�棬�е�Ϊ110.6�棬�ӷ����ܶ�Ϊ0.866g/cm3����������۵�Ϊ122.4��,��25��C��95�����ܽ�ȷֱ�Ϊ0.3g��6.9g��
i�Ʊ���Ʒ����30.0mL�ױ���25.0mLlmol/L���������Һ��100��C�·�Ӧ30min��װ����ͼ��ʾ��
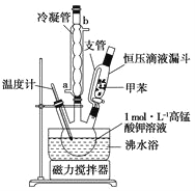
��1��ͼ�������ܵĽ�ˮ��Ϊ________(����a������b������֧�ܵ�������___________��
��2���ڱ�ʵ���У�������ƿ����ʵ��ݻ�__________(����ĸ����
A. 50mL B. I00mL C. 200mL D. 250mL
������þƾ���ֱ�Ӽ��ȣ��÷�ˮԡ���ȵ��ŵ���___________________��
ii�����Ʒ����ͬѧ����������̷���ֲ�Ʒ������ͻ��ռױ�

��3����������������___________���������ʵIJ��ᆳ��������һ���ᴿ����ɫҺ��ױ������������������______________��
iii���Ȳⶨ
��4����ȡ1.220g��Ʒ�����100mL������Һ��ȡ25.00mL��Һ����0.1000mol/L KOH�ܵζ����뱽����ǡ����ȫ��Ӧ�����ظ����Σ�ƽ��ÿ������KOH��Һ�����24.00mL����Ʒ�б����ᴿ��Ϊ______________��
��5���ⶨ��ɫ������۵㣬��������115����ʼ�ۻ����ﵽ130��ʱ�����������ۣ���ͬѧ�Ʋ��ɫ�����DZ�������KCl�Ļ����,Ӧ����___________������Ʒ�ᴿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֮�乲��һ��̼ԭ�ӵĻ������Ϊ�ݻ��������[3,3]���飨![]() �������е�һ�֡����й��ڸû������˵����ȷ����
�������е�һ�֡����й��ڸû������˵����ȷ����
A. ��ױ���C7H8����Ϊͬ���칹��
B. 1mol�û�������ȫȼ��ʱ����10 mol O2
C. ����̼ԭ�Ӿ���ͬһƽ��
D. һ�ȴ��ﹲ��3�֣����������칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������,���ڿ��淴ӦX(g)+3Y(g)![]() 2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��),�ﵽƽ��ʱ,X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1,�������ж���ȷ����(����)
2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��),�ﵽƽ��ʱ,X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1,�������ж���ȷ����(����)
A. c1��c2=3��1 B. ƽ��ʱ,Y��Z����������֮��Ϊ2��3
C. X��Y��ת���ʲ���� D. c1��ȡֵ��ΧΪ0<c1<0.14 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ѧ��Դ���������������Ź㷺��Ӧ�ã��綯�������õ�Ǧ��������һ���������״̬ͭ��Ǧ�����һ��ṹ���Ƶij���������Ǧ��Ǧ����ɣ���H2SO4�����Һ���ŵ�ʱ�ܷ�ӦΪ��Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
��1��д���ŵ�ʱ�����ĵ缫��Ӧʽ��______________________________��
��2��Ǧ���طŵ�ʱ����Һ��pH��_________�����������С�����䡱���������·����0.5mol����ͨ��ʱ����Һ������H2SO4�����ʵ���Ϊ___________��
��3���ŵ���Ըõ�ؽ��г�磬�����ӵ�Դ�ĸ���һ������________��(�Pb����PbO2��)
��.������COCl2����һ����Ҫ����ԭ�ϣ������ھ�������ϵ���������ҵ��ͨ��Cl2��g��+CO��g��![]() COCl2��g�� ��H < 0�Ʊ�����ͼΪʵ���о������������ڸ����ʵ�Ũ����ʱ��仯�����ߡ��ش��������⣺
COCl2��g�� ��H < 0�Ʊ�����ͼΪʵ���о������������ڸ����ʵ�Ũ����ʱ��仯�����ߡ��ش��������⣺

��4��0��6min�ڣ���Ӧ��ƽ������v��Cl2��=________________��
��5���÷�Ӧ��һ�δ�ƽ��ʱ��ƽ�ⳣ��Ϊ_________________��10min�ı��������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤����������ֵ������˵����ȷ����
A. ���³�ѹ�£�14 g C2H4��C3H6�Ļ�������к���̼ԭ�ӵ���ĿΪNA
B. �����£� pH =12��Na2CO3��Һ�к��е�OH-������Ϊ0. 01NA
C. ��״���£�0.56 L�����к��й��ۼ�����ĿΪ0.2 NA
D. 7.8 g Na2O2�к��е���������Ϊ0.2NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com