
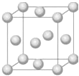
 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.分析 (1)铜是29号元素,原子核外有29个电子,根据构造原理书写其基态核外电子排布式;利用均摊法计算原子个数;
(2)①原子个数相同、价电子数相同的微粒是等电子体;
②根据价层电子对互斥理论确定杂化方式;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,根据价层电子对互斥理论确定其空间构型.
解答 解:(1)铜是29号元素,原子核外有29个电子,根据构造原理知其核外电子排布式为:1s22s22p63s22p63d104s1,价电子排布为:3d104s1,该晶胞中铜原子个数=8×$\frac{1}{8}$,故答案为:3d104s1;4;
(2)①某+1价铜的配离子为[Cu(CN)4]3-,其配体是CN-,与配体为等电子体的微粒有:CO、N2等,故答案为:CO;
②CH3CH=CH2分子中甲基上的C原子含有4个共价单键,属于sp3杂化,碳碳双键两端上的碳原子含有3个σ键,属于sp2杂化,故答案为:sp3、sp2;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,离子反应方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,SO42-中S原子价层电子对=4+$\frac{1}{2}$(6+2-4×2)=4,且不含孤电子对,所以是正四面体结构,故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;正四面体.
点评 本题主要考查物质结构,较综合,这些都是学习重点,会利用价层电子对互斥理论确定杂化方式、微粒空间构型,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g金刚石中含有碳酸键的个数为2NA | |
| C. | 25℃时1.0LpH=13的NaOH溶液中含有H+的数目为0.1NA | |
| D. | 1mol的甲基与1mol的铵银离子所含电子数均为10NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 | |
| B. | 某微粒的结构示意简图为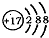 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | Be(OH)2的碱性比Mg(OH)2的碱性强 | |
| D. | 原子半径:Na>Si>O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
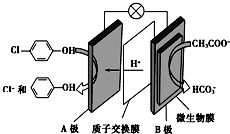 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(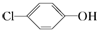 )的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+2H2O=2CO2+7H+ | |
| D. | 处理后的废水pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸镁晶体分解反应是放热反应 | B. | 氯化镁水解是熵增反应 | ||
| C. | 硫酸镁晶体分解反应是熵减反应 | D. | 氯化镁分解放热比硫酸镁少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 234U,235U,238U是不同的核素,互称同位素 | |
| B. | 陶瓷,玻璃,水晶,红宝石都属于硅酸盐 | |
| C. | Na与熔融的KCl反应能制取K,但不能证明Na的金属性比K强 | |
| D. | 在400℃,800个大气压下,钠能与二氧化碳生成钻石和石墨,反应过程中CO2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 25℃时,在 c(H+)=$\sqrt{{K}_{W}}$的溶液中,大量存在Na+、S2-、NO3-、CO32-等离子 | |
| C. | 常温,0.1mol•L-1的NaHSO3溶液的pH=6,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com