
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
分析 根据题意可知,将33gCO2通入到1000ml1.0mol•L-1的NaOH溶液中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1molCO2通入到2L1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.
解答 解:根据题意,33gCO2通入1mol•L-1NaOH溶液1000mL中充分反应,n(CO2)=$\frac{33g}{44g/mol}$=0.75mol,n(NaOH)=1mol•L-1×1L=1mol,
该反应既生成碳酸钠又生成碳酸氢钠,该反应的方程式为:3CO2+4NaOH═2NaHCO3+Na2CO3+H2O,
由0.75molCO2反应放出热量为xKJ,则3molCO2反应放出热量为4xkJ,即热化学反应方程式为
3CO2(g)+4NaOH(aq)═2NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=-4xkJ/mol①,
1molCO2通入到2L1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,
由盖斯定律$\frac{1}{2}$(①-②)可得:CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-$\frac{1}{2}$(4x-y)kJ•mol-1,
故选C.
点评 本题考查反应热与焓变的应用,题目难度中等,正确书写热化学方程式为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
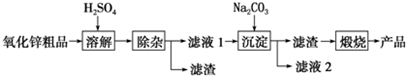
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的聚沉是化学变化 | |
| B. | 含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个 | |
| C. | 胶体的介稳性与胶体粒子直径大小有关 | |
| D. | NaCl晶体既可制成溶液又可制成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
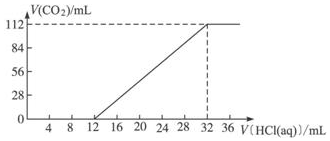 ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.
ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
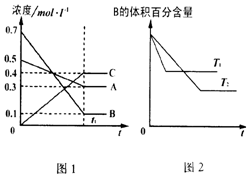
| A. | 在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动 | |
| B. | 保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| C. | T℃时,若由0.4mol•L -1A、0.4mol•L -1B、0.2mol•L -1C反应,达到平衡后,C的浓度为0.8mol•L -1 | |
| D. | 在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
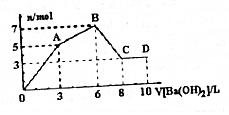 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在的形式是AlO2- | |
| B. | 原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| C. | 向D点溶液中通入过量CO2气体,最终将得到9mol沉淀 | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com