
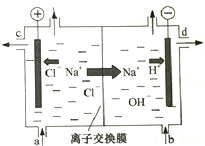
 如图是离子交换膜法电解食盐水的示意图,离子交换膜只允许阳离子通过,上述精盐水需耍进行二次精制后才能作为离子交换膜电解槽的原料.对盐水进行二次精制的目的是 ( )(选填编号)
如图是离子交换膜法电解食盐水的示意图,离子交换膜只允许阳离子通过,上述精盐水需耍进行二次精制后才能作为离子交换膜电解槽的原料.对盐水进行二次精制的目的是 ( )(选填编号)| A. | 进一步降低Ca2+,Mg2+的浓度,提高烧碱纯度 | |
| B. | 进一步降低SO42-的浓度,提高烧碱纯度 | |
| C. | 防止杂质离子与碱生成的沉淀堵塞离子交换膜 | |
| D. | 防止溶液酸性或碱性过强,腐蚀离子交换膜 |
分析 若食盐水不经过二次精制,处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,碱性条件下会生成沉淀,对装置中的交换膜产生影响,所以精制食盐水的目的是防止隔膜堵塞,提高产品的纯度,由此分析解答.
解答 解:A、精制前的食盐水中含有较多的Ca2+、Mg2+、SO42-等杂质离子,所以进行二次精制的目的是进一步降低Ca2+,Mg2+的浓度,提高烧碱纯度,故A正确;
B、SO42-不能通过阳离子交换膜,所以硫酸根离子对烧碱纯度无影响,故B错误;
C、防止碱性条件下生成氢氧化镁和微溶的氢氧化钙沉淀堵塞隔膜,故C正确;
D、离子交换膜是选择性透过膜,耐酸耐碱,故D错误;
故选AC.
点评 本题综合考查海水资源的利用,为高频考点,侧重于学生的分析能力的考查,注意把握物质分离提纯的原理,题目难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2•12H2O可除去碱性废水中的悬浮颗粒 | |
| B. | 漂白粉的主要成分为氯化钙 | |
| C. | 实验室可用浓硫酸干燥氨气和氯气 | |
| D. | 实验室可用NaOH溶液处理NO和CO废气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 已知NH4F水溶液中含有HF分子,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应是吸热反应 | |
| B. | 需要加热的反应都是吸热反应 | |
| C. | 断裂化学键要吸收能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com