
 的同系物.
的同系物. .
. ,该反应的类型是取代反应.
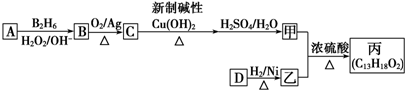
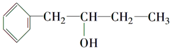
,该反应的类型是取代反应.分析 结合信息及转化关系可知A为烃,质谱法测得A的相对分子质量为56,分子中C原子数目最大数=$\frac{56}{12}$=4…8,故A为C4H8,它的核磁共振氢谱显示只有2组峰,可推知A为(CH3)2C=CH2 ,顺推可知B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,甲为(CH3)2CHCOOH,甲和乙反应生成有机物C13H18O2,应是发生酯化反应,则乙为醇,甲中含有4个碳原子,所以乙中含有9个碳原子,乙的分子式为:C9H12O,D可以发生银镜反应,含有-CHO,在催化剂存在条件下1mol D与2mol H2反应可以生成乙,丙中含有两个-CH3,而甲中含有2个甲基,故乙中没有甲基,可推知D为 ,乙为
,乙为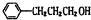 ,据此解答.
,据此解答.
解答 解:结合信息及转化关系可知A为烃,质谱法测得A的相对分子质量为56,分子中C原子数目最大数=$\frac{56}{12}$=4…8,故A为C4H8,它的核磁共振氢谱显示只有2组峰,可推知A为(CH3)2C=CH2 ,顺推可知B为CH3)2CHCH2OH,C为(CH3)2CHCHO,甲为(CH3)2CHCOOH,甲和乙反应生成有机物C13H18O2,应是发生酯化反应,则乙为醇,甲中含有4个碳原子,所以乙中含有9个碳原子,F的分子式为:C9H12O,D可以发生银镜反应,含有-CHO,在催化剂存在条件下1mol D与2mol H2反应可以生成乙,丙中含有两个-CH3,而甲中含有2个甲基,故乙中没有甲基,可推知D为 ,乙为
,乙为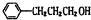 ,
,
(1)由上述分析可知,A的结构简式为:(CH3)2C=CH2 ,名称为2-甲基丙烯,
故答案为:2-甲基丙烯;
(2)B为(CH3)2CHCH2OH,分子式为C4H10O,
故答案为:C4H10O;
(3)C为(CH3)2CHCHO,与新制Cu(OH)2悬浊液反应的化学方程式为:(CH3)2CHCHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$(CH3)2CHCOONa+Cu2O↓+3H2O,
故答案为:(CH3)2CHCHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$(CH3)2CHCOONa+Cu2O↓+3H2O;
(4)根据上面的分析可知,D为 ,
,
故答案为: ;
;
(5)甲与乙反应的化学方程式为: ,该反应为取代反应,
,该反应为取代反应,
故答案为: ;取代反应;
;取代反应;
(6)甲为(CH3)2CHCOOH,根据条件①含有“-COO-”结构;②核磁共振氢谱有3组峰且峰面积比为3:2:3,即含有三种位置的氢原子,则符合条件的甲的同分异构体为CH3CH2COOCH3、CH3COOCH2CH3,其2种,
故答案为:2.
点评 本题考查有机物推断,需要对给予的信息进行利用,能较好的考查学生阅读获取信息能力,确定A的结构简式是关键,利用正推法与逆推法相结合进行推断,注意掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:解答题
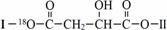 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.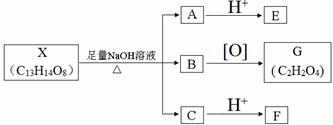
 .
.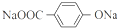 ;X的结构简式是
;X的结构简式是 .
.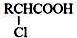 ;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH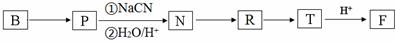
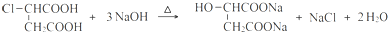 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可以由下列反应合成三聚氰胺:
可以由下列反应合成三聚氰胺: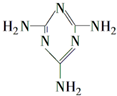 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸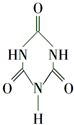 后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.
后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池负极发生氧化反应 | |
| B. | 原电池工作时溶液中的阳离子向正极移动 | |
| C. | 原电池工作时电子由负极沿导线流向正极,再经电解质溶液流回负极 | |
| D. | 原电池反应一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com