
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
分析 (1)据焓变等于反应物活化能减去生成物活化能求算焓变,再书写热化学方程式;
(2)据△H=反应物键能和-生成物键能和求算;
(3)已知①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=-akJ/mol
②N2(g)+O2(g)=2NO(g);△H2=-bkJ/mol
利用盖斯定律将$\frac{①-3②}{4}$计算;
(4)根据盖斯定律,热化学方程式Ⅱ×2-热化学方程式Ⅰ可得热化学方程式Ⅲ,从而得出目标反应Ⅲ的焓变△H3.
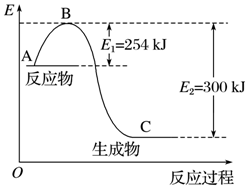
解答 解:(1)据焓变等于反应物活化能减去生成物活化能求算焓变,N2和H2反应生成2mol NH3过程中的△H=(254KJ/mol-300KJ/mol)×2=-92KJ/mol,所以热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol,故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol;
(2)设N-H的键能为a,△H=反应物键能和-生成物键能和=943KJ/mol+3×435KJ/mol-6×aKJ/mol=-92KJ/mol,即a=390,故答案为:390;
(3)已知①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=-akJ/mol
②N2(g)+O2(g)=2NO(g);△H2=-bkJ/mol
利用盖斯定律将$\frac{①-3②}{4}$可得NH3(g)+$\frac{3}{2}$NO(g)=$\frac{5}{4}$N2(g)+$\frac{3}{2}$H2O(g)△H3=$\frac{3b-a}{4}$kJ/mol,故答案为:$\frac{3b-a}{4}$;
(4)反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)═(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)═NH4HCO3(aq)△H2
根据盖斯定律Ⅱ×2-Ⅰ可得:(NH4)2CO3(aq)+H2O (l)+CO2(g)?2NH4HCO3(aq)△H3=2△H2-△H1,
故答案为:2△H2-△H1.
点评 本题考查了放热反应的图形分析、利用键能求算焓变以及盖斯定律在热化学方程式中的应用,题目难度中等,明确盖斯定律的含义及应用方法为解答关键,注意掌握热化学方程式的概念及书写原则,试题培养了学生灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ① | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
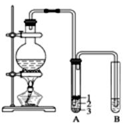 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;钙离子的电子式为:Ca2+.
;钙离子的电子式为:Ca2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 | |
| C. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| D. | c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂 | B. | 氧化剂 | C. | 还原产物 | D. | 氧化产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com