
【题目】下列递变规律不正确的是
A. N a、Mg、Al原子的失电子能力逐渐减弱
B. Si、P、S元素的最高正化合价依次降低
C. C、N、O的原子半径依次减小
D. Cl、Br、I的气态氢化物的稳定性依次减弱
科目:高中化学 来源: 题型:
【题目】铝铁合金在微电机中有广泛应用,某兴趣小组为利用废弃的铝铁合金设计了如下实验流程制备聚合硫酸铁和明矾:
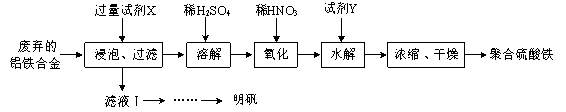
(1)聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①聚合硫酸铁可用于净水的原理是 。
②有人认为上述流程中的“氧化”设计存在缺陷,请提出改进意见: ;浓缩时向其中加入一定量的乙醇,加入乙醇的目的是 。
③加入试剂Y的目的是调节pH,所加试剂Y为 ;溶液的pH对[Fe2(OH)x(SO4)y]n 中x的值有较大影响(如图1所示),试分析pH过小(pH<3)导致聚合硫酸铁中x的值减小的原因: 。
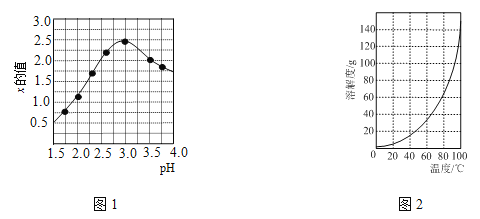
(2)明矾是一种常见铝钾硫酸盐。
①为充分利用原料, 试剂X应为 。
②请结合图2所示的明矾溶解度曲线,补充完整由滤液Ⅰ制备明矾晶体的实验步骤(可选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生,过滤, 。将溶液 、 、过滤、并用酒精洗涤、干燥,最终得到明矾晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物反应如下图,据此回答下列问题:

(1)乙烯的结构式为: 。
(2)写出反应②④的化学方程式:
② ,反应类型: (1分);
④ ,反应类型: (1分)。
(3)实验室常用下列装置制取乙酸乙酯,请回答相关问题:

①饱和碳酸钠溶液的主要作用是 。
②若要把制得的乙酸乙酯分离出来,应采用的操作是 。
③进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
元素 | 结构或性质信息 |
X | 其原子最外层电子数是内层电子数的2倍 |
Y | 基态原子最外层电子排布为nsnnpn+1 |
Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
M | 单质在常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
Q | 其与X形成的合金为目前用量最多的金属材料 |
(1)Q元素基态原子的电子排布式是________,Y原子的电子排布图是 。
(2)比较Y元素与氧元素的第一电离能____>____;X和Z形成的化合物XZ2为一种液体溶剂,其化学式是 ,分子中的![]() 键和
键和![]() 键数目之比为_____。
键数目之比为_____。
(3)写出实验室制备M单质的离子方程式 。
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是_____________,其原因是_____________________;
沸点高的是_____________,其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )

A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 12C和14N含有相同的中子数
B. 14C和14N质量数相同,互为同位素
C. 12C和13N中子数相同,质子数不同,互为同位素
D. 12CO和14CO物理性质不同,化学性质基本相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学式书写正确的是:
A.亚硫酸钠溶液显碱性:SO32-+2 H2O![]() H2SO3 +2 OH-
H2SO3 +2 OH-
B.氯化银投入水中后建立平衡:AgCl (s)![]() Ag+ (aq) + Cl-(aq)
Ag+ (aq) + Cl-(aq)
C.甲烷的燃烧热为890.3kJ·mol-1,表示甲烷燃烧热的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是 。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度下,将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
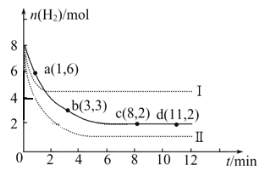
①a点正反应速率 逆反应速率(填“大于”、“等于”或“小于”),在1~3min内的平均反应速率v(H2)= 。
②仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
(3)甲醇可用于制作燃料电池,若电解质溶液为酸性,负极的电极反应式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com