
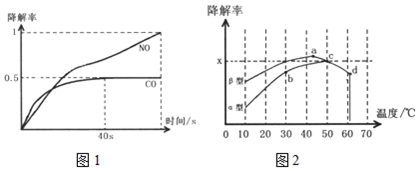
 ).
).分析 (1)据△G=△H-T△S来判断,若△G<0则能自发进行;
(2)Ⅰ.据平衡移动来分析;
Ⅱ.①k=$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)c({O}_{2})}$进行计算;
②A.平衡常数是温度的函数,温度升高向吸热方向进行,即向逆反应方向进行,k=$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)c({O}_{2})}$,故k减小;
B.相同温度下β型沥青混凝土中CO降解速率比α型要大;
C.a点的数据反映出CO降解率是整个实验过程中最高的;
D.d点降解率出现突变的原因可能是温度升高后催化剂失效;
③据催化剂能加快化学反应速率,但不影响平衡移动画图;
(3)据阳极失去电子发生氧化反应书写电极反应方程式.
解答 解:(1)①2NO(g)+O2(g)═2NO2(g)△H1=-113.0KJ/mol
②2SO2(g)+O2(g)═2SO3(1)△H2=-288.4KJ/mol,则$\frac{1}{2}×①+\frac{1}{2}×②$得NO2(g)+SO2(g)═NO(g)+SO3(1)△H3═-87.7KJ/mol<0,且可判断反应的△S<0,故在低温下△G=△H-T△S<0能自发进行,
故答案为:经计算△H3=(113.0-288.4)×0.5=-87.7KJ/mol<0,且可判断反应的△S<0,故在低温下可自发进行;
(2)Ⅰ.可能的原因是40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低,则2H2O+4NO+O2?4HNO3平衡逆向移动,造成HNO3浓度降低,
故答案为:40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低,则2H2O+4NO+O2?4HNO3平衡逆向移动,造成HNO3浓度降低;
Ⅱ.①CO的降解率为x,设起始CO浓度为1mol/L,
2CO(g)+O2(g)?2CO2(g)
开始(c) 1 0
变化 x $\frac{1}{2}$ x x
平衡 1-x 0.1 x,k=$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)c({O}_{2})}$=$\frac{{x}^{2}}{0.{1}^{2}×(1-x)^{2}}$=$\frac{100{x}^{2}}{(1-x)^{2}}$,
故答案为:$\frac{100{x}^{2}}{(1-x)^{2}}$;
②A.平衡常数是温度的函数,温度升高向吸热方向进行,即向逆反应方向进行,k=$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)c({O}_{2})}$,故k减小,即Kb>Kc,故A错误;
B.由图得,相同温度下β型沥青混凝土中CO降解速率比α型要大,故B正确;
C.a点的数据反映出CO降解率是整个实验过程中最高的,故C错误;
D.d点降解率出现突变的原因可能是温度升高后催化剂失效,故D正确;
故答案为:AC;
③据催化剂能加快化学反应速率,但不影响平衡移动,故图为 ,
,
故答案为: ;
;
(3)阳极失去电子发生氧化反应,故电极反应方程式为Ti-4e-+2H2O=TiO2+4H+,
故答案为:Ti-4e-+2H2O=TiO2+4H+.
点评 本题考查利用△G=△H-T△S来判断反应能否自发进行,平衡常数,电极反应方程式的书写等,本题难度中等.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
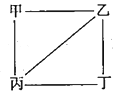 X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最小 | |
| D. | W的阴离子可能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>D>B>A | |
| B. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| C. | 最简单气态氢化物的稳定性:B>A | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①可知原溶液存在离子为NH4+,其浓度为0.01mol/L | |
| B. | 原溶液一定存在Cl- | |
| C. | 原溶液肯定没有Fe3+、Mg2+,一定含有Na+ | |
| D. | n(NH4+):n(Al3+):n(SO42-)=1:1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
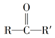 (R、R′为烃基)结构的分子
(R、R′为烃基)结构的分子 ;
;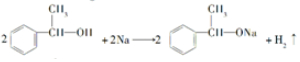 ;
;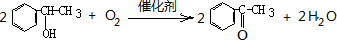 .
.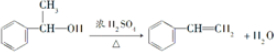 .脱水后的产物,发生聚合反应的化学方程式
.脱水后的产物,发生聚合反应的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是NaCl晶体的一个晶胞结构棋型,KO2的晶体结构与NaCl的相似,KO2可以看做是Na+的位置被K+代替,Cl-的位置被O2-代替代替.则下列关于KO2晶体结构的叙述中正确的是( )
如图是NaCl晶体的一个晶胞结构棋型,KO2的晶体结构与NaCl的相似,KO2可以看做是Na+的位置被K+代替,Cl-的位置被O2-代替代替.则下列关于KO2晶体结构的叙述中正确的是( )| A. | 与K+距离相等且最近的O2-有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是六面体 | |
| C. | 一个KO2晶胞中的K+和O2-的粒子数都是4个 | |
| D. | 与K+距离相等且最近的K+有8个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com