
| A、等体积、等物质的量浓度的氨水与盐酸混合 |
| B、pH之和为14的氨水与硝酸等体积混合 |
| C、pH之和为14的Ba(OH)2溶液与NaHSO4溶液等体积混合 |
| D、等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合 |
| 10-14 |
| 10a-14 |
| 10-14 |
| 10a-14 |


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
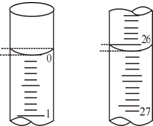 为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂.请填写下列空白:
为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测盐酸的体积/mL | 0.1000mol/LNaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 2.00 | 28.15 | 26.15 |
| 第二次 | 25.00 | 1.50 | 29.50 | 28.00 |
| 第三次 | 25.00 | 0.20 | 26.55 | 26.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量稀硫酸中和冲洗 |
| C、配制硫酸溶液时,可先在量筒中加入一定量的水,再在搅拌下慢慢加入浓硫酸 |
| D、鉴别食盐和芒硝晶体,可用口尝药品的味道,有咸味者,则为食盐晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用烧杯或烧瓶给液体物质加热时,要垫石棉网 |
| B、使用试纸检验溶液的性质时,应将试纸浸入溶液中 |
| C、用托盘天平称量氢氧化钠固体时,应将药品放在天平左盘的称量纸上 |
| D、如果某溶液中滴加BaCl2 溶液有白色沉淀生成,证明原溶液中一定含有SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
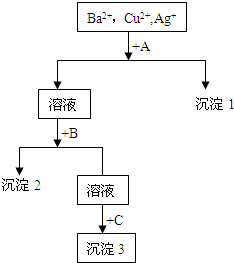 某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2CO3溶液将这三种离子逐一沉淀分离.其流程图如图所示
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2CO3溶液将这三种离子逐一沉淀分离.其流程图如图所示查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 |
| B、用过量氨水除去Fe3+溶液中的少量Al3+ |
| C、Al(OH)3中混有少量Mg(OH)2:加入过量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤 |
| D、可以用过量氢氧化钠溶液除去MgO中的少量Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、移走部分HI |
| B、减小容器容积 |
| C、通入大量氦气 |
| D、降低体系温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+3H2(g)?2NH3(g) |
| B、H2O(g)+C(s)?CO(g)+H2(g) |
| C、H2(g)+I2(g)?2HI(g) |
| D、2NO2(g)?N2O4(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com