
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
分析 0.1mol某金属单质与足量的硫酸溶液反应,放出1.12LH2(标准状况),设金属元素在化合物中的化合价为x,由电子守恒可知0.1mol×(x-0)=$\frac{1.12L}{22.4L/mol}$×2×(1-0),解得x=1,并转变为具有Ar原子的电子层结构的离子,则质子数为18+1=19,即为K,以此来解答.
解答 解:0.1mol某金属单质与足量的硫酸溶液反应,放出1.12LH2(标准状况),设金属元素在化合物中的化合价为x,
由电子守恒可知:0.1mol×(x-0)=$\frac{1.12L}{22.4L/mol}$×2×(1-0),解得:x=1,
该金属反应后转变为具有Ar原子的电子层结构的离子,则质子数=18+1=19,为K元素,
K的原子序数为19,位于周期表中第四周期第IA族,
故选B.
点评 本题考查元素周期表结构及应用,为高频考点,把握电子守恒计算元素的化合价为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉(C6H10O5)n]与纤维素(C6H10O5)n]互为同分异构体 | |
| B. | C3H6与 C2H4互为同系物 | |
| C. | TD与H2化学性质几乎相同 | |
| D. | H2O与D2O是不同核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 显蓝色;无红色沉淀;显黄色 | B. | 显蓝色;有红色沉淀;不显黄色 | ||
| C. | 不显蓝色;无红色沉淀;显黄色 | D. | 不显蓝色;无红色沉淀;不显黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹位于第六周期第VIIA族 | B. | 砹单质的氧化性比碘强 | ||
| C. | 还原性:At->I- | D. | 稳定性:HAt>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
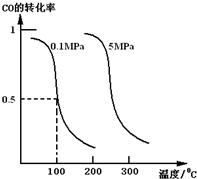 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)?CH3OH(g).
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)?CH3OH(g).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸馏、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com