
0.0012mol×
| ||
| 0.05L |
| 1000mL |
| 50mL |


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
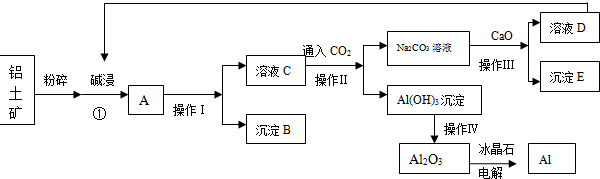
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
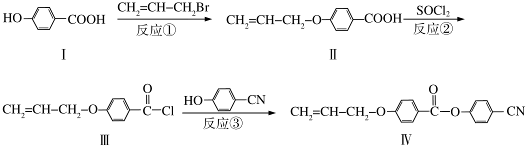
 也可与III发生类似反应③的反应生成有机物V,V的结构简式是
也可与III发生类似反应③的反应生成有机物V,V的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

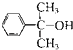
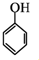 和乙酸酐为原料制备
和乙酸酐为原料制备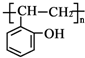 的合成路
的合成路| NaOH溶液 |
| △ |
| CH3COOH |
| 浓硫酸,△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
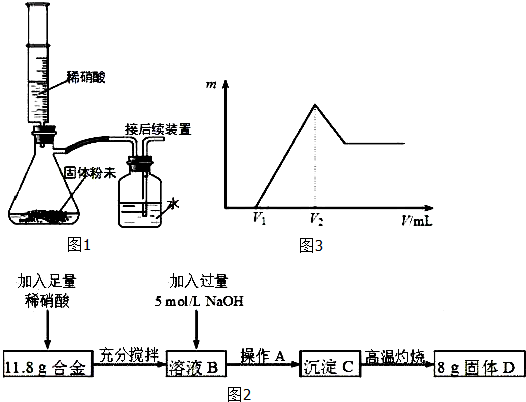
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2 O3 | CO | Fe | CO2 | |
| 甲容器 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙容器 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | A(KMnO4溶液浓度/mol?L-1) | B(草酸溶液浓度/mol?L-1) | C(硫酸溶液浓度/mol?L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
| A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | |||||||
| 浓度/mol?L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
| c(H2SO4)/mol?L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
查看答案和解析>>
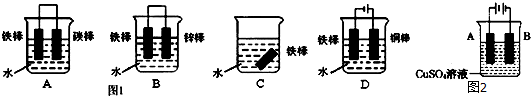
科目:高中化学 来源: 题型:
| A、反应液使红色石蕊试纸变蓝 |
| B、反应后静置,反应液不分层 |
| C、反应后静置,反应液分为两层 |
| D、反应液使蓝色石蕊试纸变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com