
| A. | N3-与CO2 | B. | BF3和C O32- | C. | NO2+与CO2 | D. | H3O+与NH3 |
分析 等电子体是指原子数目相同,价电子数目也相同的粒子,根据VSEPR理论和杂化轨道理论判断各组粒子的中心原子的杂化方式.
解答 解:A.N3-与CO2互为等电子体,对于CO2,根据VSEPR理论,中心C原子的配位原子数为BP=2,孤电子对数为LP=$\frac{4-2×2}{2}$=0,则价电子对数为VP=BP+LP=2+0=2,根据杂化轨道理论,中心C原子为sp杂化,不是sp3杂化,故A不选;
B.BF3和C O32-互为等电子体,对于BF3,根据VSEPR理论,中心C原子的配位原子数为BP=3,孤电子对数为LP=$\frac{3-1×3}{2}$=0,则价电子对数为VP=BP+LP=3+0=3,根据杂化轨道理论,中心B原子为sp2杂化,不是sp3杂化,故B不选;
C.NO2+与CO2互为等电子体,CO2中中心C原子为sp2杂化,不是sp3杂化,故C不选;
D.H3O+与NH3互为等电子体,对于H3O+,根据VSEPR理论,中心O原子的配位原子数为3,孤电子对数为LP=$\frac{6-1×3-1}{2}=1$,则价电子对数为VP=BP+LP=3+1=4,根据杂化轨道理论,中心O原子为sp3杂化,NH3分子中中心N原子也是sp3杂化,均为sp3杂化,故D选.
故选D.
点评 本题考查等电子体原理,价层电子对互斥理论,杂化轨道理论,主要考查物质结构知识,题目难度不大.


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:推断题
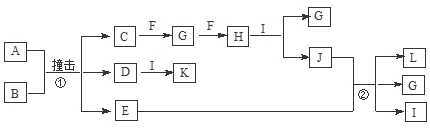
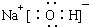 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
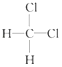 与
与 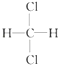 ⑤
⑤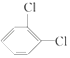 与
与 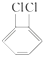
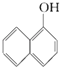 与
与 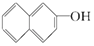 ⑦CH3-CH3和
⑦CH3-CH3和 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
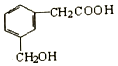
| A. | 能发生催化氧化反应 | |
| B. | 不能发生水解反应 | |
| C. | 1mol该有机物能与足量金属钠反应生成2gH2 | |
| D. | 1mol该有机物能与足量碳酸氢钠反应生成2 molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径 (×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | 元素X和Q形成的化合物中只含有离子键 | |
| B. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 | |
| C. | 常温下用单质Z做的容器不能盛装浓硫酸 | |
| D. | Y的气态氢化物与R的气态氢化物不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
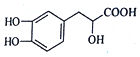
| A. | 丹参素分子中有四种官能团,它与苯甲酸不是互为同系物 | |
| B. | 丹参素分子中C原子上的H被取代,所得一氯代物有4种 | |
| C. | 在Ni催化下1 mol丹参素最多可与4 mol H2发生加成反应 | |
| D. | 等量的丹参在一定条件下分别与足量Na、NaOH溶液反应,消耗两者的物质的量之比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
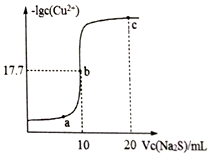 某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2.( )
某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2.( )| A. | a、b、c三点中,水的电离程度最大的为b点 | |
| B. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)═2c(Na+) | |
| C. | 该温度下Ksp(CuS)=4×10-36 mol2/L2 | |
| D. | 向100 mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Zn2+先沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com