
【题目】A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。

请填空:
(1)形成单质A的原子的结构示意图为________,它的最高化合价为________。
(2)B的化学式为_______________,B和碳反应生成A和E的化学方程式为_________________________。
(3)C的化学式为________,D的化学式为____________。
【答案】  +4 SiO2 SiO2+2C
+4 SiO2 SiO2+2C![]() Si+2CO↑ CaSiO3 Na2SiO3
Si+2CO↑ CaSiO3 Na2SiO3
【解析】
A、B、C、D、E代表单质或化合物,A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似,A是Si。B和碳在高温下反应生成A和E,则该反应是碳和二氧化硅反应生成硅和CO,即B是二氧化硅,E是CO;二氧化硅在高温下和氧化钙反应生成C是硅酸钙,二氧化硅和氢氧化钠溶液反应生成D是硅酸钠,据此判断。
根据以上分析可知A是Si,B是SiO2,C是CaSiO3,D是Na2SiO3,E是CO。则
(1)形成单质A的原子是硅原子,其结构示意图为 ,最外层有4个电子,它的最高化合价为+4价。
,最外层有4个电子,它的最高化合价为+4价。
(2)B的化学式(分子式)为SiO2,晶体类型为原子晶体,B和碳反应生成A和E的化学方程式是SiO2+2C![]() Si+2CO↑。
Si+2CO↑。
(3)C的化学式(分子式)为CaSiO3,,D的化学式(分子式)为Na2SiO3。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】如何利用实验室常见的药品试剂探究11号~17号元素的金属性逐渐减弱,非金属性逐渐增强?已知实验室有你想用到的仪器和药品、试纸等一切用品。
猜想与假设:
(1)用_________三种金属分别与水反应,通过观察生成气泡的速率便会得出从________到_________金属性逐渐减弱。
(2)因实验室不可能有硅单质,但可以测0.1mol/L的_________ 溶液和_________ 溶液及Na2SO4溶液的 pH,推断三种盐溶液的水解情况,得出_________、_________ 、硫酸三种最高价含氧酸的酸性强弱顺序是__________,从而得出从__________非金属性逐渐增强。
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将__________方法,通过__________现象便直接得出非金属性S比Cl弱。
设计和实施方案:
(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容。__________________。
(2)实验结论是___________。
(3)请你用物质结构理论知识解释结论_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)![]() zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3mol/L。则下列有关判断正确的是 ( )
zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3mol/L。则下列有关判断正确的是 ( )
A. x+y>z+m B. 混合气体的密度一定减小
C. 平衡向正反应方向移动 D. B的转化率一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石油产品A(C4H8),可以合成材料化学重要的物质G和H。己知:
①A和C的核磁共振氢谱都有2组峰,且峰面积之比分别为1∶3和1∶2
②E和F都可发生银镜反应;E的分子式为:C4H4O2
③H2C=CH2+H2O2![]()
![]()
④R-CH2-CHO+HCHO![]()
![]()
G和H的合成路线如下图所示:
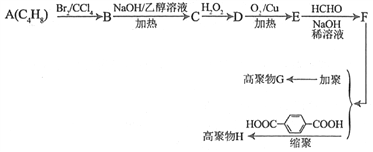
请回答下列问题:
(1)C的名称________________;F中官能团名称为____________________。
(2)A的同分异构体共有___________种(不包括A本身,不含立体异构)
(3)写出B到C的化学方程式和反应类型:
化学方程式为______________________________________________,反应类型是___________。
(4)D→E的化学方程式为___________________________________________。
(5)H的结构简式为_______________________________________________,G的结构简式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种物质所含的原子数与0.5molH2O所含原子数相等( )
A.0.6molH2O2B.0.5molH2SO4C.1molHNO3D.1.5molHe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
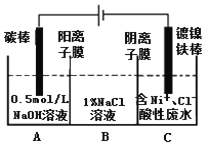
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列变化进行推断:
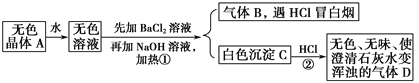
且已知A为正盐。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:①________________,②__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应条件是加热的反应都是吸热反应
B.化学反应除了生成新的物质外,还伴随着能量的变化
C.物质燃烧不一定是放热反应
D.放热的化学反应不需要加热就能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com