

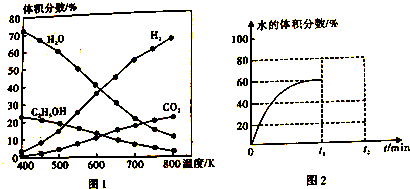
分析 (1)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;气体的体积减小,△S<0;
②利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的,根据目标方程改写分方程,然后求出反应热;
③在t1min时升温到600K,平衡逆向移动,从图1可知达平衡时H2O%大于40%小于45%,据此画出体系中水的体积分数在t1min后的变化曲线;
(2)反应⑤为CH3COOCH3+2H2?CH3CH2OH+CH3OH,据此结合V=$\frac{△C}{△t}$计算氢气的反应速率,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值.
解答 解:(1)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)正反应为气体的体积减小的反应,所以△S<0,
故答案为:<;<;
②Ⅰ2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H1
Ⅱ2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1
ⅢCO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1,将Ⅱ-Ⅲ×2得Ⅰ,所以△H1=(-253.6kJ•mol-1)-(-41kJ•mol-1)×2=-171.6kJ•mol-1,故答案为:-171.6kJ•mol-1;
③2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H1=-171.6kJ•mol-1,在t1min时升温到600K,平衡逆向移动,水的体积分数下降,从图1可知达平衡时H2O%大于40%小于45%,图象为: ,
,
故答案为: ;
;
(2)乙酸甲酯加氢得到乙醇.反应⑤为CH3COOCH3+2H2?CH3CH2OH+CH3OH,
CH3COOCH3+2H2?CH3CH2OH+CH3OH
起始(mol/L):1 2 0 0
转化(mol/L):0.75 1.5 0.75 0.75
平衡(mol/L):0.25 0.5 0.75 0.75
氢气的反应速率V(H2)=$\frac{△C}{△t}$=$\frac{1.5}{t}$mol•L-1•min-1
平衡常数K=$\frac{C(C{H}_{3}C{H}_{2}OH)×C(C{H}_{3}OH)}{C(C{H}_{3}COOC{H}_{3})×{C}^{2}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.{5}^{2}}$=9
故答案为:1.5/t mol•L-1•min-1;9.
点评 本题涉及热化学、化学反应速率和平衡的有关计算和判断知识,属于综合知识的考查题,注意化学平衡的三段式计算应用,题目难度中等.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 4 mol•L-1的KAl(SO4)2溶液与7 mol•L-1的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-=2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O | |
| D. | 食醋清除热水瓶胆水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 b.
b.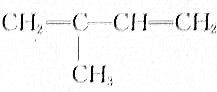
 f.HOOC(CH2)4COOH
f.HOOC(CH2)4COOH 、
、
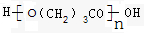
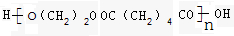 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知浓度的盐酸溶液时,锥形瓶使用前中含有少量水 | |
| D. | 用标准盐酸测定未知浓度NaOH溶液,结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
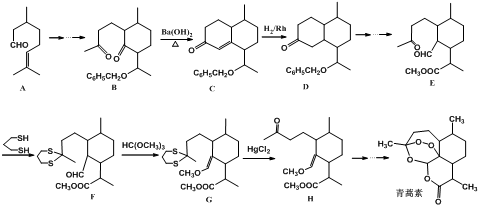
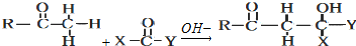
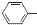 CH2CH2CHO)的路线流程图.
CH2CH2CHO)的路线流程图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H2、HClO、C2H6 | B. | CO2、N2O、HC≡CH | ||
| C. | C6H5CH3、C3H4、CH4 | D. | C6H6、C2H4、HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
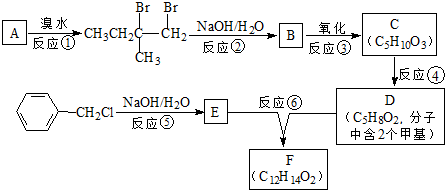
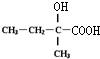
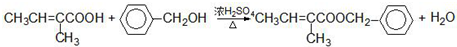 .
.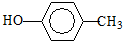 :
: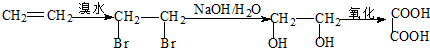 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com