
【题目】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH 与微粒浓度的变化关系如图所示。 下列说法错误的是( )
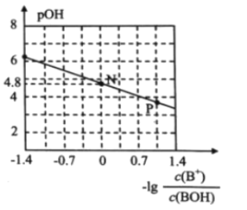
A.若向0.1mol/L BOH溶液中加水稀释,则溶液中c(OH-)/c(BOH) 增大
B.室温下,BOH的电离平衡常数K = 1×10-4.8
C.P点所示的溶液中:c(Cl-) > c(B+)
D.N点所示的溶液中: c(H+) = c(Cl-) + c(OH-) - c(BOH)
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】有如图所示A、B、C、D、E五种仪器:

(1)请选择下列仪器名称的序号,填入相应的横线上:
①蒸馏烧瓶 ②碱式滴定管 ③圆底烧瓶 ④长颈漏斗⑤分液漏斗 ⑥酸式滴定管 ⑦容量瓶
A:__________,B:__________,C:__________,D:________,E:________。
(2)上述A~E五种仪器中,使用前必须检漏的有________,组装气体发生器必须液封的是________。
(3)下列仪器中,
![]()
在灼烧固体物质时必须用到的仪器是________________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)=CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠 溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_____________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2+3H2 ![]() 2NH3刚开始时,N2的浓度为3mol·L-1 ,H2的浓度为5mol·L-1,3min后测得NH3的浓度为0.6mol·L-1则此时间内,下列反应速率表示正确的是( )
2NH3刚开始时,N2的浓度为3mol·L-1 ,H2的浓度为5mol·L-1,3min后测得NH3的浓度为0.6mol·L-1则此时间内,下列反应速率表示正确的是( )
A.v (NH3)= 0.1 mol˙L-1˙min-1B.v (N2) = 1.0 mol˙L-1˙min-1
C.v (H2) = 1.67 mol˙L-1˙min-1D.v (H2) = 0.3 mol˙L-1˙min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓是继硅之后研究最深人、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为________________,As基态原子核外有__________个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是__________,Ga、As、Se的电负性由大到小的顺序是__________________。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________,GaF的熔点超过1000℃,可能的原因是__________________________。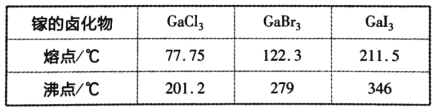
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为__________,草酸根离子中碳原子的杂化轨道类型为__________。
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为__________g·cm-3(设NA为阿伏加德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.AB3型的分子空间构型一定为平面三角形
B.电负性相差越大的元素间越易形成离子键
C.分子晶体中,分子间作用力越大,分子越稳定
D.用于幽门螺旋杆菌示踪的![]() 价电子排布为2s22p3
价电子排布为2s22p3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃下,纯水中c(H+)=1×10-7 mol·L-1,则此时c(OH-)=______________,该温度下向纯水中加盐酸,使溶液中的c(H+)=1×10-3 mol·L-1,则此时溶液的pH=_______________。若25℃下,向纯水中加入NaOH固体,使溶液的pH=13,此时溶液中c(OH-)=___________。 与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 ![]() NH4++NH2-,请写出液氨的电离平衡常数表达式K =____________________________。
NH4++NH2-,请写出液氨的电离平衡常数表达式K =____________________________。
(2)同素异形体相互转化的反应热相当少而转化速率慢,有时还很不完全,测定时很 困难,现可依据盖斯定律进行计算。已知:
P4 (白磷,s) + 5O2 (g) = 2P2O5 (s); △H1 =-283.2 kJ·mol-1 ①
4P (红磷,s) + 5O2 (g) = 2P2O5 (s); △H2 =-184.0kJ·mol-1 ②
由热化学方程式看来,更稳定的磷的同素异形体是 ______(填“白磷”或“红磷”) ,试写出白磷转化成红磷的热化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:
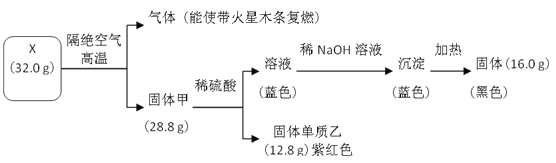
请回答:
(1)X 的化学式是______________。
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是______________。
(3)写出固体甲与稀硫酸反应的化学方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com