
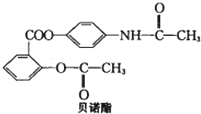
| A、分子式为C17H14O5N |
| B、在氢氧化钠水溶液中水解可以得到3种有机物钠盐 |
| C、1mol贝诺酯与H2发生加成反应最多消耗8mol H2 |
| D、贝诺酯既属于酯类又属于蛋白质类 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
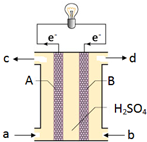 “长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A、B为正极 |
| B、从a口通入四氧化二氮气体 |
| C、从d口排除的是NO气体 |
| D、A极发生的电极反应式:C2H8N2-16e-+8H2O=CO2+N2+16H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
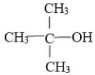
| A、能与氢氧化钠溶液反应 |
| B、4个碳原子可能在同一平面内 |
| C、与它具有相同官能团的同分异构体还有4种 |
| D、与乙醇互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=0的溶液中:Cl-、Na+、K+、C6H5-O-(C6H5一为苯基) |
| B、加入铝屑有氢气放出的溶液中:NH4+、K+、HCO3-、Br- |
| C、在H2SO3溶液中:HSO3-、K+、Cl-、Ba2+ |
| D、在葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、促进、促进 |
| B、促进、抑制 |
| C、抑制、促进 |
| D、抑制、抑制 |
查看答案和解析>>
科目:高中化学 来源: 题型:

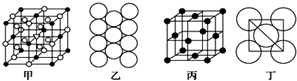
| A、用装置甲收集CH4,采取b端进气a端出气的方式 |
| B、用装置乙收集NO2气体 |
| C、用装置丙吸收NH3 |
| D、用仪器丁准确量取25.00mL酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度 |
B、如图,一段时间后给烧杯内地溶液中加入黄色的K3[Fe(CN)6]溶液,可看到Fe电极附近有蓝色沉淀生成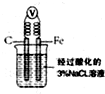 |
| C、用标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
| D、用加热的方式可提取NH4Cl固体中混有的少量的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
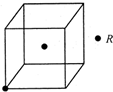 现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.
现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com