
| A. | 都导致浓度偏大 | B. | ①导致浓度偏小,②导致浓度偏大 | ||
| C. | 都导致浓度偏小 | D. | ①导致浓度偏大,②导致浓度偏小 |
分析 ①称量时天平未达平衡(左高右低),说明称量的氢氧化钠的物质的量偏小;
②定容时,眼睛俯视刻度线,加入的蒸馏水体积偏小,配制的溶液体积偏小,根据操作方法对c=$\frac{n}{V}$的影响进行分析产生的误差.
解答 解:①称量时天平未达平衡(左高右低),说明砝码的质量偏大,则称量的NaOH的质量偏小,配制的溶液中含有氢氧化钠的物质的量偏小,则所得溶液浓度偏低;
②定容时,眼睛俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,根据c=$\frac{n}{V}$可知配制的溶液浓度偏高;
根据分析可知:①导致浓度偏小,②导致浓度偏大,
故选B.
点评 本题考查了配制一定物质的量浓度的溶液中的误差分析,题目难度不大,明确正确的操作方法为解答关键,注意根据操作方法对c=$\frac{n}{V}$的影响分析误差,试题培养了学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 101mL | C. | 119mL | D. | 120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
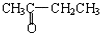 B.
B.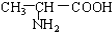 与
与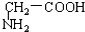
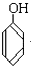 与
与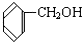 D.CH3CH2C≡CH与CH2═CH-CH═CH2E.
D.CH3CH2C≡CH与CH2═CH-CH═CH2E.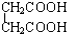 与
与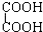 F.戊烯和环丙烯
F.戊烯和环丙烯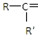 氧化成(R、R′
氧化成(R、R′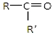 可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
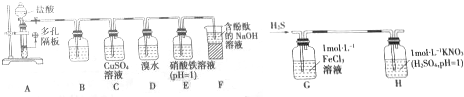
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
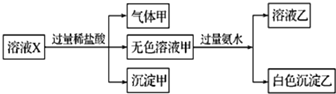
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | 仅凭以上实验不能确定SO42-是否存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+ Ba2+ A13+ |
| 阴离子 | OH- C1- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com