
将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应后过滤,弃去滤渣,滤液中 金属阳离子情况不可能是( )
A.只含 Cu2 +、Fe2+、Zn2+ B.只含 Zn2+
+、Fe2+、Zn2+ B.只含 Zn2+
C.只含 Fe2+、Zn2+ D.只含 Cu2+、Fe3+、Zn2+
科目:高中化学 来源:2016-2017学年安徽省高二上第一次月考化学试卷(解析版) 题型:选择题
加热N2O5时,发生以下两个反应:N2O5?N2O3+O2,N2O3?N2O+O2.在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol/L,c(N2O3)为1.62mol/L,则c(N2O5) 为( )
A.1.44mol/L B.3.48mol/L C. 0.94mol/L D. 1.98mol/L
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三联合考试化学试卷(解析版) 题型:实验题
光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:

回答下列问题:
(1)反应I的化学方程式为 ,氧化剂为 (填化学式)。
(2)经反应II所得的四氯化硅粗品中所含的物质如下:
组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
图中“操作X”的名称为 ;PCl3的电子式为 。
(3)反应III和IV中尾气的用途为 ;反应IV的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:实验题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;  钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 。
(3)用离子方程式表示过程III和IV中Na2CO3的主要作用 。
(4)CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2 吸水变色这一性质可制成变色水泥和显隐墨水.图2是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是 .
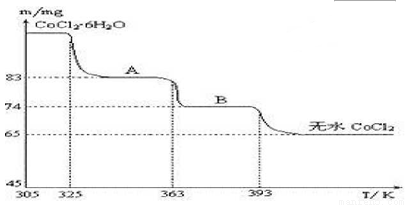
(5)某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液。下列有关该溶液中微粒的物质的量浓度关系 正确的是 (填序号)。
正确的是 (填序号)。
A.c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.将该溶液与少量NaOH 溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X 的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是()
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应速率与化学平衡
化学反应速率与化学平衡| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| i | 150 | $\frac{1}{3}$ | 0.1 |
| ii | 150 | $\frac{1}{3}$ | 5 |
| iii | 350 | $\frac{1}{3}$ | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在潮湿的空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 金属的化学腐蚀的实质是:M-ne-═Mn+,电子直接转移给还原剂 | |
| C. | 金属的化学腐蚀必须在酸性条件下进行 | |
| D. | 在潮湿的中性环境中金属的电化学腐蚀主要是吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | B. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | ||
| C. | $\frac{{3V}_{2}}{{V}_{1}}$c mol•L-1 | D. | $\frac{3{V}_{1}}{{V}_{2}}$c mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com