
【题目】某有机物A的结构简式如如图。
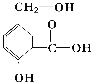
(1)请写出该物质的含氧官能团名称______、______和______。
(2)请写出以下化学反应的方程式:
①A跟NaOH溶液反应:__________
②A跟NaHCO3溶液反应:__________
③A在一定条件下跟Na反应:__________
科目:高中化学 来源: 题型:
【题目】现有下列四种重要的有机物。
CH2=CH2 

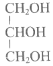
① ② ③ ④
(1)常用作液体燃料的是________(填序号,下同)。
(2)常用作配制化妆品保湿成分的是________。
(3)能用于制备酚醛树脂的是________。
(4)其产量常作为衡量石油化工发展水平的标志的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如下图:

下列说法正确的是____(选填字母)。
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=___kJ·mol一1。
N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=___kJ·mol一1。
(3)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(m mol.min一1)。

①不同催化剂存在下,氨气分解反应活化能最大的是___(填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[己知:气体分压(p分)=气体总压(p总)x体积分数]
N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[己知:气体分压(p分)=气体总压(p总)x体积分数]
(4)关于合成氨工艺的理解,下列正确的是___。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10 MPa一30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(5)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数[![]() (NH3)]。
(NH3)]。

①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)____vB(NH3)(填“>”、“<”或“=”)。
②在250℃、1.0×104kPa下,H2的转化率为______%(计算结果保留小数点后1位)。
(6)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列物质中:
(1)互为同分异构体的是______
(2)互为同素异形体的是_______
(3)互为同位素的是__________
(4)属于同一种物质的是______
(5)互为同系物的是__________ (填序号)
①液氯和氯气 ②白磷和红磷 ③(CH3)3CCH2CH3和(CH3)2CHCH(CH3)2 ④![]() 和
和![]() ⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
Ⅱ.现有6种物质:①MgCl2 ②HCl ③SO2 ④K2CO3 ⑤CaO ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨C2H6 ⑩H2O2
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是_______。
(2)只含离子键的离子化合物是______。
(3)含极性共价键的离子化合物是_________。
(4)含非极性共价键的离子化合物是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,应用这一反应,下列所给化合物中可以与钠合成环丁烷的是
A. CH2BrB. CH2BrCH2CH2CH2Br
C. CH2BrCH2CH2BrD. CH3CH2CH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.由Na2CO3 + SiO2 ![]() Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
B.氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中
C.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
D.瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)是最早制得的具有三维锂离子通道的正极材料。以MnSO4和LiFePO4为原料制备锰酸锂的流程如图:
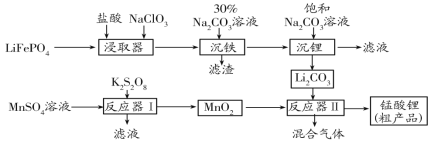
请回答下列问题:
(1)“沉铁”过程所得滤渣为白色固体,其主要成分是___。
(2)K2S2O8中S的化合价为+6价,则S2O82-中含过氧键的数目为__,反应器Ⅰ中发生反应的离子方程式__。
(3)反应器Ⅱ中反应温度为600~750℃。升温到515℃时,开始有CO2产生,比碳酸锂的分解温度(723℃)低得多,可能的原因是___。
(4)制得的锰酸锂粗产品中混有LiMnO2,写出在高温条件下反应产生LiMnO2的化学方程式___;称取一定量的锰酸锂粗产品于锥形瓶中,加入稀硫酸充分溶解,滴入含0.14molNa2C2O4的标准溶液时恰好完全反应,同时生成0.19molMn2+,则锰酸锂粗产品中LiMn2O4物质的量分数为___。 (MnO2-、Mn2O4-被还为Mn2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列说法符合“绿色化学”的是()
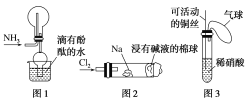
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④B.①②③C.①③④D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com