
| A. | 用酒精灯火焰的外焰部分直接加热蒸发皿底部 | |
| B. | 蒸发液体时,边加热边用玻璃棒不断搅动蒸发皿里的液体直到把液体完全蒸干 | |
| C. | 将热的蒸发皿用手拿离火焰,放在实验台上 | |
| D. | 将灼热的蒸发皿直接放在冰水中冲洗 |
分析 A.蒸发皿可以直接加热,酒精灯外焰温度较高,加热时用酒精灯的外焰进行加热;
B.蒸发液体时,不能直接蒸干,否则会导致固体飞溅;
C.移动蒸发皿应该使用坩埚钳,不能使用手直接拿,且不能直接放在试验台上;
D.将灼热的蒸发皿直接用冷水冲洗,容易炸裂.
解答 解:A.酒精灯的外焰温度较高,且蒸发皿可以直接加热,所以可用酒精灯火焰的外焰部分直接加热蒸发皿底部,故A正确;
B.蒸发液体时,边加热边用玻璃棒不断搅动蒸发皿里的液体,直到蒸发皿中有少量液体时停止加热,不能把液体完全蒸干,故B错误;
C.蒸发皿不能直接用手拿,应该使用坩埚钳,且应该放在石棉网上,故C错误;
D.若将灼热的蒸发皿直接用冷水冲洗,容易炸裂,应该放在石棉网上冷却后再冲洗,故D错误;
故选A.
点评 本题考查了蒸发皿的使用方法及注意事项,题目难度不大,注意积累可以直接加热的仪器和需要垫石棉网加热的仪器,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液中通入SO2产生白色沉淀,判断Si和S的非金属性强弱 | |
| B. | 比较H2O和H2S还原性强弱,判断O和S的非金属性强弱 | |
| C. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| D. | 铁片投入硫酸铜溶液中,铁片上有紫红色物质生成,判断Fe和Cu的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个${\;}_{55}^{137}$Cs含有82个中子 | B. | CsOH的碱性比KOH的强 | ||
| C. | HI的还原性比HF的强 | D. | KIO3是碘的最高价含氧酸的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某些分子中,化学键可能只有π键而没有σ键 | |
| B. | 当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键 | |
| C. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| D. | 含有π键的分子在反应时,π键是化学反应的积极参与者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
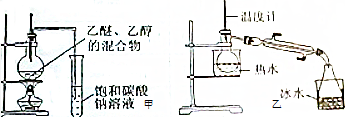
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,E离子的电子排布式为1s22s22p6,B原子的电子排布图为
,E离子的电子排布式为1s22s22p6,B原子的电子排布图为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com