
分析 (1)碳酸钠溶液中碳酸根离子水解溶液显碱性;
(2)碳酸氢钠溶液中碳酸根离子结合水电离出的氢离子促进水的电离,依据溶液中离子积常数计算水电离出来的c(OH-),在pH=3的CH3COOH溶液中醋酸电离出氢离子抑制水的电离平衡逆向进行,结合离子积常数计算溶液中水电离出的氢离子浓度;
(3)欲使平衡向左移动,且所得溶液显酸性,可加入酸或酸性的物质;
(4)一水合氨为弱电解质,不能完全电离,加水促进电离;
(5)溶液中氢离子浓度越大,则其pH越小,按照溶液中氢离子浓度由小到大顺序进行排列.
解答 解:(1)碳酸钠溶液中碳酸根离子水解溶液显碱性,离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:碱;CO32-+H2O?HCO3-+OH-;
(2)在NaHCO3溶液中,OH-全部来自于水的电离,由于溶液的pH=11,故溶液中的氢离子浓度为10-11mol/L,由水电离出来的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=1.0×10-3 mol•L-1;
pH等于3的CH3COOH溶液中C(H+)=1.0×10-3mol/L,25℃时:Kw=c(OH-)×c(H+)=10-14,溶液中的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=1.0×10-11mol/L,而在酸溶液中,氢离子几乎全部来自于酸的电离,但氢氧根全部来自于水的电离,故由水电离出的C(H+)=c(OH-)=1.0×10-11mol/L,
故答案为:1.0×10-3;1.0×10-11;
(3)欲使平衡向左移动,且所得溶液显酸性,可加入酸或酸性的物质,
A.向水中加入NaHCO3固体,碳酸氢钠是强碱弱酸盐,水解对水的电离起促进作用,平衡向右移,溶液呈碱性,故A错误;
B.向水中加入NaHSO4固体,溶液于电离出氢离子,平衡向左移,溶液呈酸性,故B正确;
C.加热至100℃,促进水的电离,溶液仍呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,NH4)2SO4是强酸弱碱盐溶液水解呈酸性,水解对水的电离起促进作用,平衡向右移,故D错误;
故答案为:B.
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<;
(5:①NaCl②NaOH③CH3COOH④HCl⑤CH3COONa⑥NaHCO3⑦Ba(OH)2,⑧Na2CO3,
显示碱性的为:②NaOH,⑤CH3COONa,⑥NaHCO3,⑦Ba(OH)2,⑧Na2CO3,Ba(OH)2和氢氧化钠为强碱,⑤CH3COONa⑥NaHCO3⑧Na2CO3为盐,所以pH⑦>②>⑧>⑥>⑤;
显示中性的为①NaCl,pH=7;
显示酸性的为:③CH3COOH④HCl,浓度相同时,盐酸为强酸,氢离子浓度最大,醋酸为一元弱酸,氢离子浓度小于盐酸,溶液的pH大小关系为:③>④,故物质的量浓度相同时,按pH由大到小的顺序为:②>⑦>⑤>①>④>⑥>③,
故答案为:⑦>②>⑧>⑥>⑤>①>③>④.
点评 本题考查了离子浓度大小比较、水的电离及其影响因素、弱电解质的电离平衡等知识,题目难度中等,试题涉及的题量较大,充分考查了学生对所学知识的掌握情况,明确溶液中水电离的氢离子浓度大小的计算方法.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca2+Cl- CO32- | B. | Na+ Ba2+ Cl- | ||
| C. | Na+ SO42- Ba2+ | D. | H+ NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
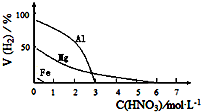 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:| 影响因素 | 实验步骤 | 实验结论 |
| 金属的种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入2mol•L-1 HNO3溶液50mL,反应结束后,用气体分析仪测定气体中H2的体积分数 | 在该浓度的稀HNO3中,Mg能反应, Fe粉不反应, |
| 硝酸的浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入0.1mol•L-1HNO3、2.0mol•L-1HNO3,反应结束后,用气体分析仪测定气体中H2的体积分数 | 硝酸浓度越稀,产生氢气越多. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③④ | C. | ①② | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
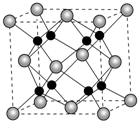 卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在.
卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在. ,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.
,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有过渡元素都是金属元素 | |
| B. | CaO2和CaCl2含有的化学键类型完全相同 | |
| C. | 非金属原子之间不可能形成离子键 | |
| D. | 有化学键断裂的过程一定属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
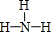 ;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是
;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是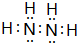 .
.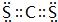 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.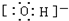 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com