
| A. | Y可能为气态 | B. | Y一定为固态或液态 | ||
| C. | Z可能为气态 | D. | Z一定为固态或液态 |
分析 扩大一倍容积,平衡时X的浓度不变,说明,减小压强时,平衡向生成X的方向移动,根据此分析解答.
解答 解:根据可逆反应X(g)+Y?2Z,温度不变时,将容器体积扩大一倍达到平衡后X的浓度不变,说明在减小压强时平衡向生成X的方向移动,若Z为气态,则减小压强时,平衡不可能向逆向移动,故Z一定为固态或液态,故D正确,C错误;若Z为固态或液态,Y为气态时,逆向为气体体积增大的方向,减小压强,平衡逆向移动,X的浓度可能达到0.06mol/L,故A正确;若Y为气态,减小压强,平衡逆向移动,X的浓度也可能达到0.06mol/L,故B错误,综上所述BC错误,AD正确.
故选:AD.
点评 本题考查化学平衡的影响因素,题目难度不大,注意根据扩大容积相当于浓度减小,体积扩大一倍时等效于浓度减小一倍,做题要全面分析.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的最高正价数一定等于其原子核外最外层电子数 | |
| B. | 原子序数为79的元素在第六周期第IB族 | |
| C. | 碱金属单质的熔、沸点从上到下递减 | |
| D. | 同周期从左到右,元素的金属性递减,非金属性递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b+2}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
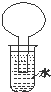 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )| A. | 只能生成CH3Cl一种有机物 | B. | 烧瓶内液面不可能上升 | ||
| C. | 大试管内的液体可能会分层 | D. | 向水中加入石蕊试液后无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
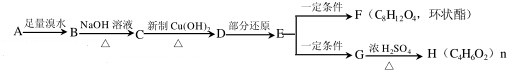
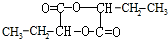 ,H
,H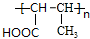 .
.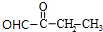 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$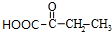 +Cu2O+2H2O,E→F2
+Cu2O+2H2O,E→F2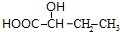 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:P>S>Cl | B. | 碱性:NaOH>KOH>RbOH | ||
| C. | 气态氢化物稳定性:HF>HCl>HBr | D. | 酸性:H2SO4>HClO4>HBrO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com