
分析 (1)当正逆反应速率相等时,可逆反应达到平衡状态,如果正逆反应速率不相等,则化学平衡一定发生移动;
(2)根据反应物、生成物的状态及影响化学平衡的因素进行判断;
(3)分析可逆反应特点,然后根据浓度、温度对化学平衡的影响进行解答;
(4)根据(3)中温度、压强对化学平衡的影响进行解答
解答 解:(1)化学平衡状态的特征为V(正)=V(逆),所以化学平衡发生移动的本质原因是正逆反应速率不相等,即V(正)≠V(逆),
故答案为:a;
(2)反应A.2NO2(g)?N2O4 (g)△H<0中,反应前后气体体积不相等,反应为放热反应,则温度、压强、浓度都会影响化学平衡,但是催化剂不影响平衡,所以反应A适合于研究温度、压强、浓度对平衡应的影响,即abc正确;
反应FeCl3+3KSCN?Fe(SCN)3+3KCl在溶液中进行,压强和催化剂不影响平衡,而温度和浓度会影响平衡,所以B适合研究温度、压强对平衡的影响,即ab正确,
故答案为:abc;ab;
(3)a.浓度:将FeCl3与KSCN反应后所得的混合液分为3等份,Fe3++3SCN-?Fe(SCN)3,Fe(SCN)3为血红色,分别加入浓FeCl3溶液、浓KSCN溶液和NaCl固体,观察现象,现象:加入浓FeCl3溶液后,铁离子浓度增大,平衡向着正向移动,Fe(SCN)3浓度增大,则混合溶液红色变深;加入浓KSCN溶液后,增大了SCN-浓度,平衡向正方向移动,混合溶液红色也变深;加入NaCl固体后,对平衡无影响,混合溶液红色不变,
故答案为:变深;变深;不变;
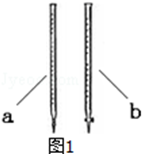
b.温度:将密封并相互连通的盛有NO2的两个玻璃球,一个放人热水中,另一个放入冷水中;
现象:由于反应2NO2(g)?N2O4 (g)△H<0为放热反应,升高温度后平衡向着逆向移动,二氧化氮浓度增大,球内红棕色变深;
放入冷水中,平衡向着正向移动,二氧化氮浓度减小,则球内红棕色变浅,
故答案为:变深;变浅;
(4)根据(3)浓度、温度对化学平衡的影响可知:在其它条件不变时,增大反应物浓度,平衡向正方向移动;升高温度,平衡向吸热方向移动,降低温度,平衡向放热方向移动,
故答案为:在其它条件不变时,增大反应物浓度,平衡向正反应方向移动;升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热方向移动.
点评 本题探究温度、压强、浓度对化学平衡的影响,题目难度不大,注意掌握影响化学平衡的因素,明确化学平衡移动的根本原因,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 39K+和40Ca2+微粒中的电子数和中子数都相等 | |
| B. | D2和He在同温同压时,若体积相等,则质量相等 | |
| C. | 同一元素的各种同位素的物理性质、化学性质均不相同 | |
| D. | 两个质量数和电子数都相等的微粒不一定是同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷可用氧化铁作催化剂实现选择性地催化脱硝.
甲烷可用氧化铁作催化剂实现选择性地催化脱硝.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
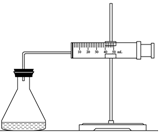 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧根离子的电子式是: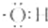 | B. | 甲烷分子的比例模型是: | ||
| C. | 硝基的表示方法-NO2 | D. | 饱和烃的通式是CnH2n+2(n≥1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的硝化反应中,向浓硫酸中加浓硝酸制得混合酸 | |
| B. | 向稀氨水中逐渐加入硝酸银溶液来配制银氨溶液 | |
| C. | 向相对过量的氢氧化钠溶液中滴入少量硫酸铜溶液以配制新制氢氧化铜 | |
| D. | 溴乙烷在氢氧化钠溶液的存在下进行水解后,加入硝酸银溶液,可检验溴离子的存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com