
【题目】研究弱电解质的电离,有重要的实际意义。
Ⅰ. 醋酸是一种常见的有机酸。
(1)醋酸的电离方程式为__________________________________________________。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是________。
A. c(CH3COO-) B. c(H+)
C. c(OH-) D. CH3COOH电离平衡常数
(3)向0.1 mol·L-1 CH3COOH溶液中加水稀释,c(CH3COO-) / c(CH3COOH)的比值将________(填“变大”、“不变”或“变小”)。
(4)下列事实一定能说明CH3COOH是弱电解质的是____________(填字母)。
A. 相同温度下,浓度均为1 mol·L-1的盐酸和醋酸的导电性对比:盐酸>醋酸
B. 1 mol·L-1 CH3COOH溶液能使紫色石蕊试液变红
C. 25℃时,1 mol·L-1 CH3COOH溶液的pH约为2
D. 10 mL 1mol·L-1的CH3COOH溶液恰好与10 mL 1mol·L-1 NaOH溶液完全反应
Ⅱ. 对比酸性的相对强弱
(5)现有a. CH3COOH b. HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
① 将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a_______b。
② pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a_______b。
③ 将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a_______b。
④ 相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a_______b。
(6)某些弱酸的电离常数如下:
化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
电 离 常 数 | 1.8×10-5 | 1.3×10-1 | 4.9×10-10 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
①下列反应可以发生的是__________(填字母)。
A. CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
②25℃时,将20 mL 1 mol·L-1 CH3COOH溶液和20 mL 1 mol·L-1 HSCN溶液分别与20 mL1 mol·L-1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式。__________
 。
。
【答案】 CH3COOH![]() CH3COO-+H+ B 变大 AC < > < > BC
CH3COO-+H+ B 变大 AC < > < > BC 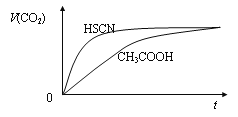
【解析】醋酸为弱酸,存在电离平衡:CH3COOH![]() CH3COO-+H+ 加入碱,促进电离,加水稀释后,溶液中除氢氧根离子浓度增大外,其它离子浓度均减小;只有证明出醋酸溶液存在电离平衡,才能证明醋酸为弱酸;pH相同的盐酸和醋酸,溶液中氢离子浓度相等,但是醋酸浓度大于盐酸;体积、浓度相等的盐酸和醋酸,溶液中氢离子浓度盐酸的大,但是两种酸中溶质的量相等;酸和盐发生反应要根据酸的强弱进行分析,一般遵循强酸制备弱酸的规律;据以上分析解答问题。
CH3COO-+H+ 加入碱,促进电离,加水稀释后,溶液中除氢氧根离子浓度增大外,其它离子浓度均减小;只有证明出醋酸溶液存在电离平衡,才能证明醋酸为弱酸;pH相同的盐酸和醋酸,溶液中氢离子浓度相等,但是醋酸浓度大于盐酸;体积、浓度相等的盐酸和醋酸,溶液中氢离子浓度盐酸的大,但是两种酸中溶质的量相等;酸和盐发生反应要根据酸的强弱进行分析,一般遵循强酸制备弱酸的规律;据以上分析解答问题。
Ⅰ.(1)醋酸为弱酸,部分发生电离,电离方程式为CH3COOH![]() CH3COO-+H+ ;正确答案:CH3COOH
CH3COO-+H+ ;正确答案:CH3COOH![]() CH3COO-+H+。
CH3COO-+H+。
(2)通入氨气,促进CH3COOH的电离,则c(CH3COO-)增大,A错误;通入氨气,c(OH-)增大,c(H+)减小, B正确.;通入氨气,c(OH-)增大, C错误;由于温度不变,CH3COOH的电离平衡常数不变, D错误;正确选项B。
(3)向0.1 mol·L-1 CH3COOH溶液中加水稀释,促进电离,CH3COOH分子个数减小,氢离子、醋酸根离子个数增大,因此c(CH3COOH)减小的程度比c(CH3COO-)减小的程度大,因此c(CH3COO-) / c(CH3COOH)的比值将变大;正确答案:变大。
(4)A. 在相同条件下,醋酸溶液的导电性比盐酸的弱,说明醋酸的电离程度小于氯化氢,氯化氢为强电解质,则醋酸为弱电解质,A正确;B. 使紫色石蕊试液变红,只能说明溶液显酸性,不能证明酸的强弱,B错误;C. 25℃时,如果1 mol·L-1的盐酸,溶液的pH=0,现1 mol·L-1 CH3COOH溶液的pH约为2,可以证明醋酸为弱酸,C正确;D. 酸提供扥溶质的量与碱提供溶质的量相等,二者恰好完全反应,不能证明醋酸为弱酸,D错误;正确选项AC。
Ⅱ.(5)①弱酸稀释时,电离程度增大,pH变化慢,所以pH相同的两种酸溶液分别稀释100倍后,pH a<b;正确答案:<。
②当它们pH相同时,溶液中氢离子浓度相同,醋酸为弱酸,醋酸浓度大于盐酸,醋酸溶质的量较大,因此与足量的锌反应,生成氢气的量多,a>b。正确答案:>。
③体积相同、pH相同的两种酸,醋酸的浓度大于盐酸的浓度,所以醋酸溶质的量大于盐酸的量,所以分别与同浓度、同体积的氢氧化钠反应,盐酸完全反应生成氯化钠,溶液显中性,醋酸有剩余,溶液显酸性,a < b。正确答案:<。
④酸抑制水电离,氢离子浓度越大,对水的平衡抑制程度越大,相同物质的量浓度的两种酸溶液中,盐酸提供氢离子浓度大,对水的平衡抑制程度较大,因此a> b;正确答案:>。
(6)①A.由电离平衡常数可知,醋酸酸性大于碳酸,所以2CH3COOH+Na2CO3= H20+CO2↑+2CH3COONa,A错误;B.由电离平衡常数可知,醋酸酸性大于氢氰酸,所以CH3COOH+NaCN=CH3COONa+HCN能发生,B正确;C.次氯酸酸性小于碳酸而大于碳酸氢根离子,所以CO2+H2O+NaClO=NaHCO3+HClO,C正确; D.碳酸的酸性大于氢氰酸,所以NaHCO3+HCN=NaCN+H2O+CO2↑不能发生,D错误;正确选项BC。
②HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,两种酸的溶质的量相等,因此与等量的NaHCO3反应生成的CO2气体体积相同;CO2气体体积(V)随时间(t)的变化关系如下图: ;正确答案:
;正确答案: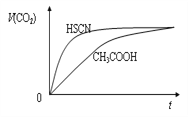 。
。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中通入一定量的HI气体,使其在一定条件下发生反应:2HI(g)![]() H2(g)+I2(g)。下列叙述中,一定属于平衡状态的是
H2(g)+I2(g)。下列叙述中,一定属于平衡状态的是
A. HI、H2、I2的浓度相等
B. 混合气体的颜色不再变化
C. 混合气体的总压强不再变化
D. v(HI)∶v(H2)∶v(I2)=2∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下实验探究某矿石(仅含四种短周期元素)的组成和性质,已知矿石含有一定的结晶水:
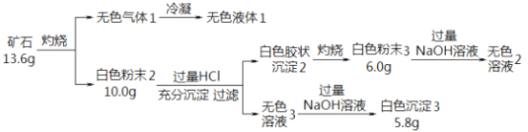
(1)矿石的组成元素是 H、O 和_____、 ______(填元素符号),化学式为_____________。
(2)白色粉末3 溶于NaOH溶液的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按纯净物、混合物、电解质和非电解质顺序排列的一组物质是( )
A.盐酸、空气、醋酸、干冰B.胆矾、海水、硫酸钠、蔗糖
C.胶体溶液、食盐、烧碱、氯化钙D.胆矾、大理石、氯化钾、硫酸钡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种说法中,正确的是:
A. O2与O3互为同素异形体,但两者之间的转化属于物理变化
B. 设NA为阿伏加德罗常数的值,则6.2g 白磷(P4)含有0.3NA P-P键
C. 足球烯与金刚石互为同分异构体,但二者形成的晶体类型不同
D. 12C与14C的质子数和电子数都为6,故二者是碳元素的同一种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1 mol/L 体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是

A. N点:c(Na+)=c(Y- )+c(HY)
B. M点:c(X-)>c(Na+)
C. 滴至pH=7时,消耗NaOH溶液的体积:HX>HY
D. 滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氢吡喃(DHP)常用作有机合成中的保护基。
(1)按照如下路线可以制得DHP。

①单糖A的分子式为_____, DHP分子的核磁共振氢谱有_____组峰。
②1mol糠醛与3mol H2反应转化为B,则B的结构简式为_____。
③ DHP的同分异构体中,属于链状有机物且能发生银镜反应的有_____种。
(2)已知:i. DHP的保护和脱保护机理为
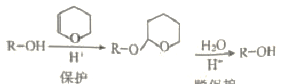
ii. R-C≡CNa + R1OH → R-C≡CH + R1ONa
iii. R-C≡CNa + R1Br → R-C≡C-R1+ NaBr
应用DHP作保护基合成梨小食心虫性外激素的路线如下:
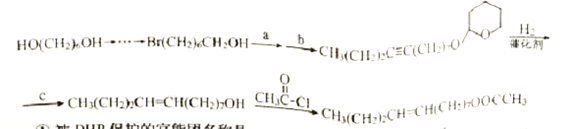
①被DHP保护的官能团名称是_______,保护反应的类型是 ______。
②上述路线中最后一步反应的方程式为 ______。
③上述路线中步骤a、b、c分别为_______、 ______、_______。(例:  )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况符合的是
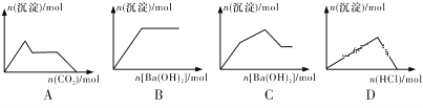
A. 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C. 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D. 向NaAlO2溶液中逐滴加入盐酸至过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com