
常温下下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+
C.c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42—、SCN-
科目:高中化学 来源:2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷(解析版) 题型:选择题
CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:CuCl2溶与乙二胺(H2N—CH2—CH2—NH2),可形成配离子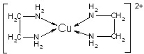 ,该配离子不存在的化学键类型类型有( )
,该配离子不存在的化学键类型类型有( )
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省华蓥市高一下期末化学试卷(解析版) 题型:选择题
在2A+B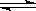 3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( )
A.VA==0.5 mol/(L•s) B. VB==0.3 mol/(L•s)
C.VC==4.8 mol/(L•min) D. VD==1 mol/(L•s)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
25℃时,KSP Mg(OH)2 = 5.61 ×10-12 ,KSP MgF2 = 7.42 ×10-11下列说法正确的是
A.25℃时,固体Mg(OH)2在20ml0.01 mol·L-1氨水中的KSP比20mL0.01 mol·L-1NH4Cl溶液中的KSP小
B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
C.25℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
D.25℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期末化学试卷(解析版) 题型:填空题
研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g)△H2 =+41.2kJ•mol-8平衡常数K2 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJ•mol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为________;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是________________________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)反应CO(g)+2H2(g) CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。
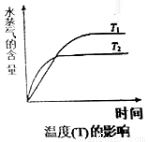
①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);该温度下反应的化学平衡常数K为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期末化学试卷(解析版) 题型:选择题
电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图。下列有关说法错误的是
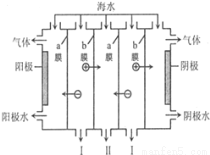
A.阳极可发生电极反应:2Cl--2e-═Cl2↑
B.阴极附近溶液的pH减小
C.a膜为阴离子交换膜,b膜为阳离子交换膜
D.I、II分别是淡水、浓海水出口
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期末化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.有单质参加的反应一定是氧化还原反应
B.化学反应速率变化时,化学平衡一定发生转移
C.化学反应速率和限度均可通过改变相应的化学反应条件而改变
D.自发进行的氧化还原反应理论上可以设计成原电池,而电解池反应一定是非自发进行的氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省等三校高一下期末化学试卷(解析版) 题型:选择题
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是
A. X的能量一定低于M的,Y的能量一定低于N的
B. 因为该反应为吸热反应,故一定要加热反应才能进行
C. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D. X和Y的总能量一定低于M和N的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com