
【题目】下列有关说法错误的是
A. NaCl晶胞中Na+的配位数为6且构成正八面体
B. 由石墨比金刚石稳定可知:C(金刚石,s) ===C(石墨,s) ΔH>0
C. 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol。假设熔化热完全用于打破冰的氢键,最多能破坏冰中15%的氢键,则每摩尔冰中平均有2 mol氢键
D. 石墨中的碳原子采用sp2杂化构成平面层状结构,12g石墨中碳碳键数为1.5NA
【答案】B
【解析】
A、NaCl晶体中,距Na+最近的Cl-有6个,这6个离子构成一个正八面体,故A正确;B、石墨比金刚石稳定,说明等质量时,石墨的总能量小于金刚石的总能量,因此金刚石转化为石墨是放热反应,△H<0,故B错误;C、冰的熔化热相当于破坏![]() mol也就是0.3mol氢键所需的能量,若熔化热最多能破坏15%的氢键,则每摩尔冰中平均有氢键
mol也就是0.3mol氢键所需的能量,若熔化热最多能破坏15%的氢键,则每摩尔冰中平均有氢键![]() =2mol,故C正确;D、石墨中每个碳原子形成3个共价键,则碳原子的价层电子对数为3,所以属于sp2杂化,每个共价键由两个碳原子构成,则平均1mol碳原子具有1.5mol碳碳单键,所以12g石墨中含有碳碳键数为1.5NA,故D错误。故选B。
=2mol,故C正确;D、石墨中每个碳原子形成3个共价键,则碳原子的价层电子对数为3,所以属于sp2杂化,每个共价键由两个碳原子构成,则平均1mol碳原子具有1.5mol碳碳单键,所以12g石墨中含有碳碳键数为1.5NA,故D错误。故选B。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】蒸馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐折算成二氧化硫)。原理是利用如图装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液。

实验步骤如下:
I.SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300 mL; 锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液; 打开冷凝水,通氮气,滴入盐酸10mL; 加热烧瓶A并保持微沸约3min后,用0.01000mol/L 碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL;
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL.
(1)仪器C的名称______。仪器B的入水口为_______(填“a”或“b”)。
(2)滴入盐酸前先通氮气一段时间作用是________,测定过程中氮气的流速过快会导致测量结果______。(填“偏大”“偏小”“不变”)
(3)①滴定过程中使用的滴定管为_________。
A.酸式无色滴定管 B.酸式棕色滴定管 C.碱式无色滴定管 D.碱式棕色滴定管
②滴定时锥形瓶中反应的离子方程式为________,滴定终点的现象是________。
(4)空白实验的目的是________。
(5)该中药中含SO2含量为________mg/ kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X和Y中,X原子的最外层电子数是内层电子总数的一半,Y元素在X元素的前一周期,Y2离子和Ne原子的电子层结构相同。有关X和Y形成的化合物Z的说法中,正确的是
A. Z肯定不是酸酐B. Z是一种碱性氧化物
C. Z的分子式可能是X2Y5D. Z是一种离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池在充电时因容易形成枝晶而导致稳定性和安全性存在问题,近日我国多个科研部门联合研究出了一种锂钠合金作负极材料的 Li/Na-O2电池,该电池使用了三氟甲磺酸钠(NaCF3SO3)的四乙二醇二甲醚( TEGDME)溶液作为电解液,其简化结构如图所示,电池工作时正极材料表面生成Li2O2和Na2O2,下列说法错误的是

A. 外电路中电子由锂钠合金电极移向碳纳米管电极
B. 电解液中的溶剂四乙二醇二甲醚不能换成水
C. 电池工作时消耗标准状况下的22.4LO2,转移电子数为4NA
D. 充电时阳极反应之一是Na2O2-2e-=2Na++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气是H2和CO的混合气体,工业上可以用于合成氨、生产低级醇等,请回答下列相关问题。
(1)sparg工艺是生产合成气的方法之一,该方法可将甲烷和二氧化碳在高温下转化为H2和CO,该反应的化学方程式为___________。
(2)工业生产中用合成气合成乙醇的反应为2CO(g)+4H2(g)![]() C2H5OH(g)+H2O(g) △H=akJ/mol①生产过程中会发生副反应2CO(g)+3H2(g)
C2H5OH(g)+H2O(g) △H=akJ/mol①生产过程中会发生副反应2CO(g)+3H2(g)![]() CH3CHO(g)+H2O(g) △H=b kJ/mol②
CH3CHO(g)+H2O(g) △H=b kJ/mol②
又已知2H2(g)+O2(g)=2H2O(g) △H=ckJ/mol③
则C2H5OH(g)催化氧化生成CH3CHO(g)和水蒸气的热化学方程式为__________________。
(3)向2L的恒温恒容密闭容器中充入4 molCO和6molH2,若只发生反应①,达平衡时容器中压强是起始压强的0.6倍,则CO的平衡转化率为___________,该温度下反应①的平衡常数等于___________。下列选项不能证明反应①达到平衡状态的是___________(填标号)。
A.混合气体的平均分子量不再改变
B混合气体的密度不再改变
C.CO和H2的物质的量之比不再改变
D.每断开4 molH-H键的同时断开3 mol H-O键
(4)以醋酸为溶剂,甲醇与合成气可以转化为乙醇,同时会生成醚类、酯类等副产物,下图是醋酸与甲醇的质量比对生产的影响,则工业生产中醋酸与甲醇的最佳质量比是___________。随着醋酸和甲醇的质量比增大,一定范围内甲醇的转化率升高而醚类选择性降低的原因可能是___________(从平衡移动角度解释)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钙晶体(CaC2O4·H2O)是一种受热容易分解的盐,某班同学要探究其受热分解的产物,甲组同学认为其分解产物可能是CaCO3、CO和H2O,乙组同学认为其分解产物可能是CaO、CO2和H2O。两组同学将草酸钙晶体放入石英试管进行加热,按照下图所示装置进行探究,请回答相关问题。
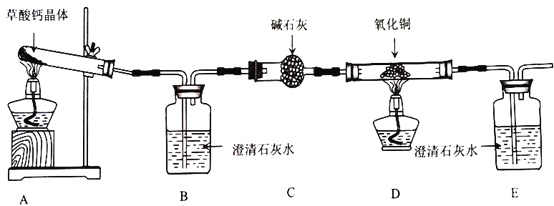
(1)盛放碱石灰的仪器名称是___________。证明分解产物中有CO的现象是______________________。
(2)装置存在一处明显缺陷,该缺陷是________________,改进的方法是______________________(任写一种)。
(3)实验中B中澄清石灰水未变浑浊,甲组同学认为自己的判断正确,但乙组同学认为可能是因为温度不够,需将试管下方酒精灯更换为___________重新实验。
(4)更换仪器及各种试剂后重新实验,B中澄清石灰水变浑浊,装置C的作用是______________________。
(5)更换仪器重新实验时发生的反应方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se 元素是人类必须的微量元素之一。下列说法不正确的是
A.SeO2 可以被氧化B.H2Se 比 H2S 不稳定
C.Se 原子的半径比 Cl 原子大D.是性质最接近金属的非金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态砷原子的价电子排布式为____。
(2)氟、氧、砷三种元素的电负性由大到小的顺序是____(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反:Fe(SCN)3+6NH4F=== (NH4)3FeF6+3NH4SCN
①NH4F 中阳离子的立体构型为____。
②(NH4)3FeF6存在的微粒间作用力有__(选填序号,下同)。
a.离子键 b.共价键 c.金属键 d.配位键 e.范德华力 f.氢键
③已知SCN中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为____,该原子团中σ与π键个数比为____。
(4)FeCl3晶体易溶于水、乙醇,受热易气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:____。
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为 ___。设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)____cm。
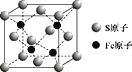
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空:
(1)4.5 g水与____ g 硫酸所含的分子数相等,它们所含氧原子数之比是____,氢原子数之比是____。
(2)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D,现将16 g A与70 g B的混合物充分反应后,生成2 mol D和一定量的C,则D的摩尔质量是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com