工业催化剂K
3[Fe(C
2O
4)
3]?3H
2O是翠绿色晶体,在421~553℃时,分解为Fe
2O
3、K
2CO
3、CO、CO
2、H
2O.实验室由草酸亚铁晶体(FeC
2O
4?2H
2O)、草酸钾(K
2C
2O
4)、草酸(H
2C
2O
4)和双氧水(H
2O
2)混合制备.请回答下列问题:
(1)写出H
2O
2的电子式
;[Fe(C
2O
4)
3]
3-的名称是
.
(2)配平反应:
FeC
2O
4?2H
2O+
H
2O
2+
K
2C
2O
4+
H
2C
2O
4═
K
3[Fe(C
2O
4)
3]?3H
2O
(3)制备过程要防止草酸被H
2O
2氧化,请写出草酸被H
2O
2氧化的化学反应方程式
.
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu
2++4NH
3?[Cu(NH
3)
4]
2+,其稳定常数表达式为:
k=.已知K[Fe(C
2O
4)
3]
3-=10
20,K[Fe(SCN)
3]=2×10
3,能否用KSCN溶液检验K
3[Fe(C
2O
4)
3]?3H
2O中的铁元素?
(填“是”“否”).
(5)铁元素可形成多种配合物,其中一种配合物钾盐A是有争议的食品添加剂.经组成分析A仅含K、Fe、C、N四种元素.取36.8gA加热至400℃,分解成KCN、Fe
3C、C、N
2,生成的氮气折合成标准状况下的体积为2.24L,Fe
3C质量是C质量的3倍,Fe
3C物质的量是氮气物质的量的1/3.则A的化学式为
.

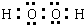 ,[Fe(C2O4)3]3-为络离子,名称为三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根),故答案为:
,[Fe(C2O4)3]3-为络离子,名称为三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根),故答案为: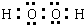 ;[Fe(C2O4)3]3-为络离子,名称为三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根);
;[Fe(C2O4)3]3-为络离子,名称为三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根);