
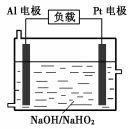
 已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:分析 ①在燃料电池的正极上发生得电子的还原反应,氧的化合价在降低,则是HO2-得电子,据此写出电极反应式;
②根据电子转移数量来确定放电量之间的关系;
③金属铝可以和氢氧化钠反应生成偏铝酸钠和氢气.
解答 解:①在燃料电池的正极上发生得电子的还原反应,根据电池反应:2Al+3HO2-═2AlO2-+OH-+H2O,所以电极反应为:3HO2-+3H2O+6e-═9OH-(或HO2-+H2O+2e-═3OH-),
故答案为:3HO2-+3H2O+6e-═9OH-(或HO2-+H2O+2e-═3OH-);
②根据电池反应:2Al+3HO2-═2AlO2-+OH-+H2O,负极反应是Al失电子,普通锌锰干电池中负极上是金属锌失电子,当消耗相同质量的负极活性物质时,设质量为mg,则铝失电子为:$\frac{m}{27}$×3,锌失电子为:$\frac{m}{65}$×2,转移电子的物质的量之比是$\frac{1}{9}$:$\frac{2}{65}$≈3.6,
故答案为:3.6;
③金属铝可以和氢氧化钠反应生成偏铝酸钠和氢气,实质是:2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑.
点评 本题综合考查原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该题的关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在 | |
| B. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 | |
| C. | 加入Ba(NO3)2,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 | |
| D. | 用洁净的铂丝蘸取溶液放在火焰上灼烧,观察到火焰呈黄色,可确定有Na+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基本相等 | |
| B. | 100 mL 1 mol•L-1的盐酸和50 mL 2 mol•L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等 | |
| C. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等. | |
| D. | 100 mL 0.1mol•L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
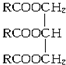 (R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
(R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com