
分析 X、Y、Z、W是元素周期表前四周期中常见的元素,X的基态原子核外的三个能级上电子数相等,原子核外电子排布为1s22s22p2,则X为C元素;
Y的单质在空气中燃烧生成一种淡黄色的固体,则Y为Na元素,淡黄色固体是过氧化钠;
Z元素原子的最外层电子数比次外层电子数少2个,故Z原子最外层电子数为6,且原子序数大于Na,则Z为S元素;
W的内层电子已充满,最外层只有一个电子,则W为Cu元素;
(1)C在第二周期第IVA族,Cu失去2个电子后剩余27个电子;
(2)电子层数越多,离子半径越大;
(3)最高价氧化物对应水化物的酸性越强,其非金属性越强,依据强酸制取弱酸原理解答即可;
(4)C易溶于二硫化碳中,类比二氧化碳的结构分析二硫化碳即可,氢氧化钠与碳酸氢钠反应生成碳酸钠和水,据此书写离子反应方程式;
(5)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式,然后计算焓变即可.
解答 解:X、Y、Z、W是元素周期表前四周期中常见的元素,X的基态原子核外的三个能级上电子数相等,原子核外电子排布为1s22s22p2,则X为C元素;
Y的单质在空气中燃烧生成一种淡黄色的固体,则Y为Na元素,淡黄色固体是过氧化钠;
Z元素原子的最外层电子数比次外层电子数少2个,故Z原子最外层电子数为6,且原子序数大于Na,则Z为S元素;
W的内层电子已充满,最外层只有一个电子,则W为Cu元素,综上所述:X为碳、Y为钠、Z为硫、W为铜,
(1)X元素为C,C在周期表中的位置是:第二周期第IVA族;W为Cu,故Cu2+离子的核外电子排布式为:1s22s22p63s23p63d9,
故答案为:第二周期第IVA族;1s22s22p63s23p63d9;
(2)电子层数越多,离子半径越大,Na离子和S离子比较,半径较大的是 S2-,S元素和氧元素的简单气态氢化物沸点不同的原因是:水分子间存在氢键,增大分子之间的相互作用,故答案为:S2-;水分子间存在氢键,增大分子之间的相互作用;
(3)S元素的非金属性比C强,可由一复分解反应推测而得,反应的化学方程式为:H2SO4+Na2CO3=H2O+CO2↑+Na2SO4,
故答案为:强;H2SO4+Na2CO3=H2O+CO2↑+Na2SO4;
(4)C单质易溶于X与Z形成的三原子化合物(CS2)中,CS2的结构类似与二氧化碳,其结构为S=C=S,故此分子中的π键与σ键的个数之比是2:2=1:1,Na元素最高价氧化物对应水化物为氢氧化钠(NaOH),氢氧化钠与小苏打反应生成碳酸钠和水,离子方程式为OH-+HCO3-=CO32-+H2O,故答案为:1:1;OH-+HCO3-=CO32-+H2O;
(5)①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ/mol,
②2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ/mol,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ/mol,
由盖斯定律①+$\frac{1}{2}$×②+③得到:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=+64.39kJ/mol+$\frac{1}{2}$×(-196.46kJ/mol)+(-285.84kJ/mol)=-319.68kJ/mol,故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol.
点评 本题结合元素周期律知识,考查反应热的有关计算、离子核外电子排布、离子反应方程式的书写等,为高频考点,侧重于学生的分析能力和计算能力的考查,明确反应热和化学计量数的关系是解题关键,题目难度不大.注意盖斯定律的应用.


科目:高中化学 来源: 题型:选择题
| A. | 体系压强保持不变 | B. | 混合气体颜色保持不变 | ||
| C. | SO3与NO的体积比保持不变 | D. | 每消耗1molSO2,同时生成1molNO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 改变的条件 | 压强 | 温度 | 平衡体系增加H2 | 催化剂 |
| 变化的示意图 |  | 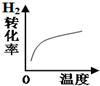 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | GaN中的氮和镓均属于第IIIA族元素 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气 SO2、NO、NO2、CO | |
| B. | 碱性溶液 Na+、K+、NO3-、CO32- | |
| C. | 酸性溶液 Na+、ClO-、SO42-、SiO32- | |
| D. | KNO3溶液 Fe2+、H+、Cl-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4分子中所有原子共平面 | B. | C2H4既作氧化剂,又作还原剂 | ||
| C. | HCN分子中既含σ键又含π键 | D. | 转移0.2mol电子,生成2.24L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “静电除尘”、“汽车尾气的催化净化”都有利于提高空气的质量 | |
| B. | 减少化石燃料的使用,有利于降低空气中PM2.5的含量 | |
| C. | 石油的分馏是获得芳香烃的主要途径 | |
| D. | 医用酒精是用淀粉类植物发酵经蒸馏、加工制成,浓度通常是75% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com