
已知H2A为弱酸,下列说法错误的是
A.0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+ c(H2A)= 0.1mol/L
B.常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5
C.常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性
D.常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9
科目:高中化学 来源: 题型:
下列关于有机物的说法,正确的是
( )
A.棉线和蚕丝都能水解生成葡萄糖
B.CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
C.1 mol 甲烷和1 mol 氯气在光照条件下充分反应,生成1 mol CH3Cl
D.乙酸乙酯中含有的杂质乙酸可用NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,ag某物质在足量的O2中燃烧,将产物通过足量的Na2O2,固体质量增加了bg,若b>a则符合此条件的物质是( )
A.CH4 B.HCOOH C.CO D.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )


A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为________________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧热的热化学方程式:
_____________________________________________________________________。
⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式为_______________。
⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
 2Z + FeG2
2Z + FeG2 Fe + 2ZG
Fe + 2ZG
放电时,电池的正极反应式为_______________________:
充电时,_____________(写物质名称)电极接电源的负极,该电池的电解质为___________________。
II. 如图是甲烷燃料电池原理示意图,回答下列问题:
(1)电池的负极是__________(填“a”或“b”),该极的电极反应是:__________。
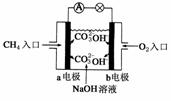
(2)电池工作一段时间后电解质溶液的pH__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g)  2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 |
|
|
|
|
(2)在5000C有催化剂存在的条件下,向容积为2L的甲乙两个密闭容器中均充入2molSO2和1molO2。甲保持容积不变,乙保持压强不变,充分反应后,均达平衡状态,此时SO3的体积分数甲
乙。(填“>”“<”或“=” )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“=” )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
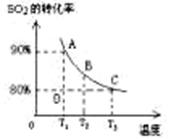 A.相同温度下新平衡时容器中的压强是原平衡时的两倍
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。
(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中导电性最强的是
A.5L 0.1 mol ·L-1NH3·H2O B.5L mol ·L-1 盐酸
C.0.1L 0.1 mol ·L-1H3PO4溶液 D.0.1L 0.1 mol ·L-1 Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g+Y(g) Z(g)+W(s) ΔH>0 下列叙述正确的是
Z(g)+W(s) ΔH>0 下列叙述正确的是
A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
设C+CO2 2CO(正反应吸热),正反应的反应速率为v1;N2+3H2
2CO(正反应吸热),正反应的反应速率为v1;N2+3H2 2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1 和v2的变化情况为
2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1 和v2的变化情况为
A.v1减小,v2增大 B.同时减小
C.v1增大,v2减小 D.同时增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com