
| A. | 高分子分离膜 | B. | 隐形眼镜 | C. | 人造丝 | D. | 人造骨酪 |
科目:高中化学 来源: 题型:选择题
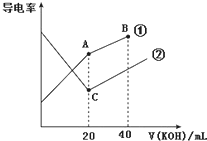 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1 KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol•L-1 KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1 mol•L-1 KOH溶液滴定CH3COOH溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.05 mol•L-1 | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 少量Ba(OH)2 | 反应结束后,c(CO32-)减小 |
| B | 再加入等量Na2CO3 | 溶液中c(CO32-)<c(HCO3-) |
| C | 100mLH2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 冰醋酸 | $\frac{c(C{O}_{3}^{2-})}{c(HC{{O}_{3}}^{-})}$增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:4 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 自来水的体积 | KI溶液的体积 | 消耗的Na2S2O3溶液的体积 |
| 1 | 10.00mL | 10.00mL | 19.96mL |
| 2 | 10.00mL | 10.00mL | 20.04mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
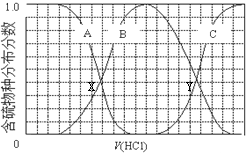
| A. | 含硫物种B表示HS- | |
| B. | 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)] | |
| C. | X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值 | |
| D. | NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-═CuS↓+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
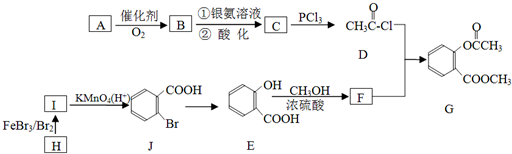
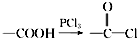 ,请回答以下问题:
,请回答以下问题: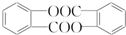 .
.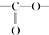 结构
结构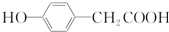 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com