
| A. | Ag+、NH4+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | K+、Na+、SO42-、Cl- | D. | Ba2+、CO32-、NO3-、K+ |
分析 A.银离子与氯离子、氢氧根离子反应,铵根离子与氢氧根离子反应;
B.铜离子为有色离子,不满足溶液无色的条件;
C.四种离子之间不发生反应,能够共存;
D.钡离子与碳酸根离子反应生成难溶物碳酸钡.
解答 解:A.Ag+与OH-、Cl-,NH4+、OH-之间发生反应,在溶液中不能大量共存,故A错误;
B.Cu2+为有色离子,不满足溶液无色的要求,故B错误;
C.K+、Na+、SO42-、Cl-之间不反应,在溶液中能够大量共存,故C正确;
D.Ba2+、CO32-之间反应生成碳酸钡沉淀,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2CH2OH | D. | CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
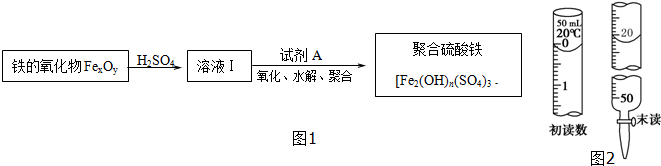
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量溶液Ⅰ于试管A、B中 | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者均可作为水果催熟剂 | |
| B. | 二者均可使酸性高锰酸钾溶液褪色 | |
| C. | 常温常压下二者均为难溶于水的气体 | |
| D. | 在一定条件下二者均能与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察沉淀的生成 | 检验是否含SO42-离子 |
| B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HClO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2具有氧化性和导电性,故可作为铅蓄电池的负极材料 | |
| B. | 炭具有还原性,一定条件下能 将二氧化硅还原为硅 | |
| C. | 酒精能使蛋白质溶液沉淀析出,可以用来分离提纯蛋白质溶液 | |
| D. | Al的金属较强,可用作飞机火箭的结构材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com