
【题目】甲醇是一种新型的汽车动力燃料。请回答下列问题:
(1)工业上可通过CO和H2化合来制备CH3OH(g)。已知某些化学键的键能数据如下表:
化学键 | C-C | C-H | H-H | C-O |
| H-O |
键能/kJmol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知:CO中的C与O之间形成的化学键为![]() 键。工业制备甲醇的热化学方程式__________________;
键。工业制备甲醇的热化学方程式__________________;
(2)在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适的催化剂(体积可以忽略不计)后,在250℃下开始反应,并用压力计检测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到20min时,以CO表示的平均反应速率为___________,该温度下平衡常数K= ______;若升高温度,则CO的转化率_______(填“增大”“减小”或“不变”);
(3)在三个容积均为1 L的恒容密闭容器中只发生反应:2CH3OH(g) ![]() C2H4(g)+2H2O(g),依据表中的相关数据可确定该反应的ΔH______0(填“>”“<”或“=”,下同);容器C达到平衡时,容器中总压强p(C)/p(A)_______2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时,υ(正)_______υ(逆)。
C2H4(g)+2H2O(g),依据表中的相关数据可确定该反应的ΔH______0(填“>”“<”或“=”,下同);容器C达到平衡时,容器中总压强p(C)/p(A)_______2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时,υ(正)_______υ(逆)。
容器 | 温度/℃ | 起始加入量/mol | 平衡时乙烯/mol | ||
CH3OH(g) | C2H4(g) | H2O(g) | |||
A | 310 | 0.2 | 0 | 0 | 0.05 |
B | 327 | 0 | 0.1 | 0.2 | 0.047 |
C | 310 | 0.2 | 0.1 | 0.2 | / |
【答案】CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116 kJmol-1 0.0125molL-1min-1 4 减小 < < <
CH3OH(g) ΔH=-116 kJmol-1 0.0125molL-1min-1 4 减小 < < <
【解析】
(1)依据△H=反应物键能总和-生成物键能总和计算ΔH,再写出热化学方程式;
(2)通过(1)写出的热化学方程式可知反应是气体体积减小的放热反应,当反应进行到20min时反应达到平衡状态,依据反应速率概念υ= ![]() 计算速率,平衡常数是利用平衡状态下生成物浓度幂次方乘积除以反应物浓度的幂次方乘积得到;结合温度对平衡的影响分析判断;
计算速率,平衡常数是利用平衡状态下生成物浓度幂次方乘积除以反应物浓度的幂次方乘积得到;结合温度对平衡的影响分析判断;
(3)根据2CH3OH(g) ![]() C2H4(g)+2H2O(g),A、B起始充入的物质等效,根据容器A、B结合温度对平衡的影响分析判断;容器C中起始时气体的物质的量相当于A的2倍,根据压强对平衡的影响分析判断;根据三段式计算A容器的平衡常数K,容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,计算出Qc,根据Qc与K的大小分析判断。
C2H4(g)+2H2O(g),A、B起始充入的物质等效,根据容器A、B结合温度对平衡的影响分析判断;容器C中起始时气体的物质的量相当于A的2倍,根据压强对平衡的影响分析判断;根据三段式计算A容器的平衡常数K,容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,计算出Qc,根据Qc与K的大小分析判断。
(1)CO(g)+2H2(g)![]() CH3OH(g),反应的△H=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能,△H═1072kJ/mol+2×436kJ/mol-(3×413kJ/mol +358kJ/mol+ 463kJ/mol) =-116kJmol-1,故答案为:CO(g)+2H2(g)
CH3OH(g),反应的△H=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能,△H═1072kJ/mol+2×436kJ/mol-(3×413kJ/mol +358kJ/mol+ 463kJ/mol) =-116kJmol-1,故答案为:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-116 kJmol-1;
CH3OH(g) ΔH=-116 kJmol-1;
(2)从反应开始到20min时,设CO的浓度变化量是x,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
初始浓度(mol/L):0.5 1 0
变化浓度(mol/L): x 2x x
平衡浓度(mol/L):0.5-x 1-2x x
根据反应前后压强之比等于物质的量之比,则![]() =
=![]() ,解得x=0.25mol/L,从反应开始到20min时,以CO表示的平均反应速率υ(CO)=
,解得x=0.25mol/L,从反应开始到20min时,以CO表示的平均反应速率υ(CO)=![]() =
=![]() =0.0125mol/(Lmin);平衡常数K=
=0.0125mol/(Lmin);平衡常数K=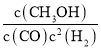 =
=![]() =4;该反应为放热反应,温度升高,平衡逆向移动,CO的转化率减小,故答案为:0.0125mol/(Lmin);4;减小;
=4;该反应为放热反应,温度升高,平衡逆向移动,CO的转化率减小,故答案为:0.0125mol/(Lmin);4;减小;
(3)根据2CH3OH(g) ![]() C2H4(g)+2H2O(g),A、B起始充入的物质等效,比较容器A、B可知,升高温度,平衡时乙烯的量减少,说明升高温度平衡逆向移动,因此正反应为放热反应,即△H<0;容器C中起始时气体的物质的量相当于A的2倍,若平衡等效,在体积相同时,平衡压强应该为A的2倍,但增大压强,平衡逆向移动,气体的物质的量减少,因此平衡时容器中总压强p(C)/p(A)<2;对于A容器,
C2H4(g)+2H2O(g),A、B起始充入的物质等效,比较容器A、B可知,升高温度,平衡时乙烯的量减少,说明升高温度平衡逆向移动,因此正反应为放热反应,即△H<0;容器C中起始时气体的物质的量相当于A的2倍,若平衡等效,在体积相同时,平衡压强应该为A的2倍,但增大压强,平衡逆向移动,气体的物质的量减少,因此平衡时容器中总压强p(C)/p(A)<2;对于A容器,
2CH3OH(g) ![]() C2H4(g)+2H2O(g),
C2H4(g)+2H2O(g),
初始浓度(mol/L):0.2 0 0
变化浓度(mol/L):0.1 0.05 0.1
平衡浓度(mol/L):0.1 0.05 0.1
平衡常数K=![]() =0.05,容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时Qc=
=0.05,容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时Qc=![]() =0.1>K,平衡逆向移动,说明υ(正)<υ(逆),故答案为:<;<;<。
=0.1>K,平衡逆向移动,说明υ(正)<υ(逆),故答案为:<;<;<。


科目:高中化学 来源: 题型:
【题目】B. [实验化学]
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图 所示) 加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80 ~ 90益下,反应约3h,冷却至室温,抽滤。步骤3:将滤液真空蒸发浓缩,冷却结晶。
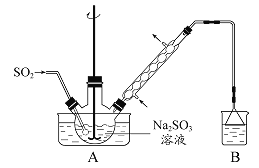
(1)装置B 的烧杯中应加入的溶液是 。
(2)①步骤2 中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是
。②冷凝管中回流的主要物质除H2O 外还有 (填化学式)。
(3)①抽滤装置所包含的仪器除减压系统外还有 、 (填仪器名称)。②滤渣的主要成分有 、 (填化学式)。
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解。步骤3 中不在敞口容器中蒸发浓缩的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过![]() 容积的试管加热
容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤加热坩埚要垫上石棉网
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管竖直伸入试管内滴加液体
⑨稀释浓硫酸时,应沿器壁缓缓地将水加入浓硫酸中
⑩用镊子从煤油中取出金属钠,再用小刀切一小块,然后将剩下的钠放回原瓶
A.①④⑦⑩B.①④⑤⑦⑩C.①④⑤⑦⑧⑩D.④⑤⑦⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.侯氏制碱法:NH3+CO2+H2O=![]() +
+ ![]()
B.小苏打溶液与稀硫酸混合:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向Ba(OH)2溶液中加少量NaHCO3: ![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
D.硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 相对分子质量为72的某烷烃,一氯代物有8种
B. 聚合物![]() 可由单体CH2=CHCH3CH=CH2加聚制得
可由单体CH2=CHCH3CH=CH2加聚制得
C. CH3CH(OH)CH(CH3)2的名称为2-甲基-3-丁醇
D. 植物油氢化、塑料和橡胶的老化过程中均发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物有很多,其中Cu2S、Cu2O、CuCl都是用途非常广泛的一价铜的化合物。回答下列问题:
(1)已知:2Cu(s)+O2(g)=2CuO(s) ΔH1=-314 kJmol-1
4CuO(s)=2 Cu2O(s)+ O2(g) ΔH2=+292 kJmol-1
固相法制备Cu2O的反应CuO(s)+ Cu(s)=Cu2O(s)的ΔH=________
(2)辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
① 粗铜应与直流电源的_____ 极(填“正”或 “负”)相连。
② 铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是________ 。
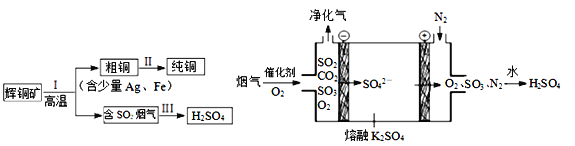
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经上右图所示方法脱除SO2,并制得H2SO4,在阳极生成SO3的电极反应式是____________________________。
(4)反应2CuCl(s) + Hg22+(aq) ![]() Hg2Cl2(s) +2Cu+(aq)达到平衡时,平衡常数K≈_____(保留两位有效数字)。[已知Ksp(CuCl)=1.2×10-6、Ksp (Hg2Cl2)=1.3×10-10]
Hg2Cl2(s) +2Cu+(aq)达到平衡时,平衡常数K≈_____(保留两位有效数字)。[已知Ksp(CuCl)=1.2×10-6、Ksp (Hg2Cl2)=1.3×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2 (亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:___。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是__(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是___(填序号)。
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):

(1)Ⅰ的分子式为_____________;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为______________________________________________________。
(2)反应②的反应类型是____________,反应④的反应类型是___________________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为:_____________________________________________________________________。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下,![]() 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com