
已知:SO +Br2+H2O―→SO
+Br2+H2O―→SO +2Br-+2H+。某溶液中可能含有Na+、NH
+2Br-+2H+。某溶液中可能含有Na+、NH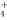 、Fe2+、K+、Br-、SO
、Fe2+、K+、Br-、SO 、SO
、SO ,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A.肯定不含Br- B.无法确定SO 是否存在
是否存在 
C.肯定含有SO D. 肯定含有Na+
D. 肯定含有Na+
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:实验题
| 实 验 步 骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的10mL 0.5mol/L BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的10mL 0.5mol/L Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体. | 白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过测定大米浸泡液的pH检验大米新鲜度 | |
| B. | 用含Fe2+的检测试剂检验自来水中余氯的含量 | |
| C. | 向食盐样品中加还原剂和淀粉检测食盐的含碘量 | |
| D. | 通过观察放入检测液中鸡蛋的沉浮检验鸡蛋新鲜度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{自动失水}{→}$
$\stackrel{自动失水}{→}$ +H2O
+H2O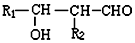
 ;G:(CH2OH)3CCHO.
;G:(CH2OH)3CCHO. .
. .
. (写一种).
(写一种).查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:填空题
某大型精炼铜厂,在电解铜的阳极泥中含有 3-14% Se 元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金 属及贵金属.从阳极泥中提取Se 的流程如下:
属及贵金属.从阳极泥中提取Se 的流程如下:

已知:SeO2在773K时为气态
(1)流程②的作用 工业提取 Se 的流程中,可循环利用的物质是
(2)H2SeO3与SO2的离子反应方程式为 .
(3)上述工业提取 Se 的流程中,SeO2、H2SO4 (浓)、SO2 的氧化性由强到弱的顺序是
(4)单质硒可能成为环境污染物,可通过与浓HNO3反应生成SeO2来回收Se,Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式: 如不对该反应还原产物的比例作限制,该反应 出现多组配平系数(填“可能”或“不可能”)
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
美国通用原子能公司(GA)提出的碘硫热化学循环是由反应Ⅰ、Ⅱ、Ⅲ三步反应组成的(如下图所示),下列有关说法正确的是( )

A.设计该循环是为了制取能源气体O2
B.图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应
C.图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行
D.整个循环过程中产生1 mol O2的同时产生44.8 L H2
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质 | 实际应用 | |
A. | 三价铁比二价铜氧化性强 | FeCl3腐蚀Cu |
B. | 次氯酸盐具有氧化性 | 次氯酸钙可做漂白剂 |
C. | 稀硝酸可与银反应 | 稀硝酸可除去试管内壁 |
D. | HF能与Si反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
下列说法中不正确的是( )
A.常温下,向100gNaOH饱和溶液中加入0.39gNa2O2固体,恢复到常温,NaOH溶液的物质的量浓度一定不变
B.向一恒容容器中充入1molN2和1molH2,在一定条件下反应并达到平衡。升温,再次达到平衡状态,N2的体积分数一定不变
C.向50mL0.55mol/L的NaOH溶液中加入50mL0.50mol/L的稀盐酸,测定中和热,继续加入6mL等浓度的稀盐酸,测定的中和热一定不变
D.将2.3gNa投入100mL水中,产生H2,若在反应前向水中加入100 mL煤油,则产生H2的速率一定不变
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:填空题
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10?3mol·L?1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO | SO | NO | NO | Cl? |
c/(mol·L?1) | 8.35×10?4 | 6.87×10?6 | 1.5×10?4 | 1.2×10?5 | 3.4×10?3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________增加压强,NO的转化率__________(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率__________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反 应中,在反应ClO +2SO
+2SO ==2SO
==2SO +Cl?的平衡常数K表达式为__________。
+Cl?的平衡常数K表达式为__________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。已知下列反应:
SO2(g)+2OH?(aq)==SO (aq)+H2O(l)ΔH1
(aq)+H2O(l)ΔH1
ClO?(aq)+SO (aq)==SO
(aq)==SO (aq)+Cl?(aq)ΔH2
(aq)+Cl?(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO (aq)ΔH3
(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ClO?(aq)+2OH?(aq)==CaSO4(s)+H2O(l)+Cl?(aq)的ΔH=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com