
(10分)Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的化学键的类型为 。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式 。
(1) 二 ⅴA (2)Al(OH)3+ OH-= AlO2-+ 2H2O;
(3) 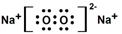 离子键,非极性键;(4)H2S + H2O2 =S↓+ 2H2O
离子键,非极性键;(4)H2S + H2O2 =S↓+ 2H2O
【解析】
试题分析:根据题意可知这几种元素分别是:Q是N;W是O;X是Na;Y是Al;Z是S。(1)N元素在周期表中位于第二周期第ⅴA 族;(2)NaOH与Al(OH)3反应的两种方程式是Al(OH)3+ OH-= AlO2-+ 2H2O;(3)Na在氧气中燃烧生成Na2O2,其电子式是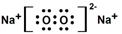 ;在该物质含有的化学键是离子键、非极性共价键。(4)H2S有还原性,而 H2O2有氧化性,二者发生氧化还原反应的化学方程式是H2S + H2O2 =S↓+ 2H2O 。
;在该物质含有的化学键是离子键、非极性共价键。(4)H2S有还原性,而 H2O2有氧化性,二者发生氧化还原反应的化学方程式是H2S + H2O2 =S↓+ 2H2O 。
考点:考查元素的推断、元素在周期表中的位置、结构、性质、电子式、化学方程式、离子方程式的书写。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
在炼铜的过程中发生:Cu2S + 2Cu2O = 6Cu + SO2↑,则下列叙述正确的是
A.该反应从电子转移角度看,与SO2 + 2H2S = 3S + 2H2O是同一反应类型
B.该反应从电子转移角度看,每生成6 mol铜,转移电子12 mol
C.该反应中,氧元素氧化了硫元素
D.该反应中,Cu2S既是还原剂又是氧化剂
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:填空题
(6分)Zn?MnO2干电池应用广泛,其电解质溶液是ZnCl2?NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2?NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(g)+Y2(g) 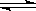 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D.Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2  Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是 ( )
Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是 ( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是( )
A.锂电极作电池负极,放电过程中发生还原反应
B.1 mol SOCl2发生电极反应转移的电子数为4 mol
C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2
D.组装该电池必须在无水、无氧的条件下进行
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
一定条件下,将A、B、C三种物质各1 mol通入一个密闭容器中发生反应:2A+B 2C,达到化学反应限度时,B的物质的量可能是( )
2C,达到化学反应限度时,B的物质的量可能是( )
A.1.5 mol B.1 mol C.0.5 mol D.0
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市高一下学期期末考试化学试卷(解析版) 题型:实验题
(9分)一定量的浓硫酸与足量Zn充分反应时有SO2和H2生成。某校化学研究性学习小组从定性方面对此作了研究。
按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊,后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。
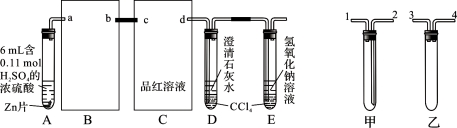
试回答下列问题:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;D、E两支试管中CCl4的作用是________________________。
(2)能证明浓硫酸具有强氧化性的实验现象为_______________________________;实验过程中,浓硫酸表现强氧化性的反应方程式是:
____________________________________________________________________
(3)反应较长时间后气泡量又会明显增加的原因是________________________________
____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
某气态烃1 mol 恰好与2 mol HCl加成,生成物分子中的氢又可被6 mol Cl2取代,则此气态烃可能是
A.C2H2B.C2H4C.CH≡C—CH3D.CH2=C(CH3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com