
| A. | 20mx | B. | 20x/m | C. | 25mx | D. | 50m/x |
分析 电解M(NO3)x溶液时某一极质量增至m g,则Mx++xe-=M,n(H2O)=$\frac{0.36g}{18g/mol}$=0.02mol,发生2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑~4e-,由电子守恒可知,存在xH2O~2M,以此来解答.
解答 解:电解M(NO3)x溶液时某一极质量增至m g,则Mx++xe-=M,n(H2O)=$\frac{0.36g}{18g/mol}$=0.02mol,发生2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑~4e-,由电子守恒可知,存在xH2O~2M,n(M)=0.02mol×$\frac{2}{x}$=$\frac{0.04}{x}$mol,金属M的相对原子质量为$\frac{m}{\frac{0.04}{x}}$=25mx,
故选C.
点评 本题考查电化学反应的计算,为高频考点,把握发生的电极反应、电解反应为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
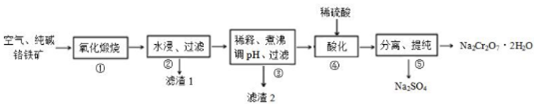
 ,
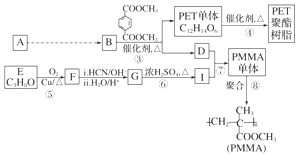
,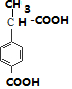 ,
,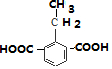 ,
,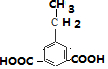 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色 | 氧化性:Cl2>Br2 |
| B | 室温下,向浓度均为0.1moL•L-1的KCl和KI混合溶液中滴加几滴AgNO3溶液,只出现黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| C | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
| D | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧得到固体残留物 | 该固体为NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高压钠灯能发出透雾能力强的淡紫色光,常用做路灯 | |
| B. | 用水清洗盛装过浓硫酸的铁捅要远离火源 | |
| C. | 理电池应用广泛,是因为锉能直接与水反应,不需要特殊的电解质溶液 | |
| D. | 据报导,一定条件下氢气可转变为金属氢,金属氢具备超导等优良性能.由氢气转变为金属氢属于同一元索的同位素之间的转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com