
| A. | N2和O2的反应 | B. | Na和O2的反应 | C. | Fe和Cl2的反应 | D. | 铜和硝酸的反应 |
分析 A、氮气和氧气化合产物是NO;
B、金属钠和氧气反应生成氧化钠,反应和物质的浓度无关;
C、金属铁和氯气反应只生成氯化铁;
D、金属铜和浓硝酸反应以及和稀硝酸反应的产物不同.
解答 解:A、氮气和氧气化合产物是NO,反应和物质的浓度无关,故A错误;
B、金属钠和氧气反应生成氧化钠,反应和物质的浓度无关,故B错误;
C、金属铁和氯气反应只生成氯化铁,反应和物质的浓度无关,故C错误;
D、金属铜和浓硝酸反应以及和稀硝酸反应的产物不同,前者产生的是二氧化氮,后者产生的是一氧化氮,故D正确.
故选D.
点评 本题考查物质浓度不同,反应产物不同,此题是对物质之间反应浓度的不同导致的结果不同的考查,熟悉物质的性质和反应的条件是解题关键,题目难度不大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解搅拌时有液体飞溅 | |
| B. | 取KMnO4样品时不慎在表面沾了点蒸馏水 | |
| C. | 定容时俯视容量瓶刻度线 | |
| D. | 定容摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室将硫酸铜溶液直接加热蒸干来制取CuSO4•5H2O | |
| B. | 用湿润的pH试纸来测溶液的pH | |
| C. | 不慎将浓碱溶液沾到皮肤上,可先立即用稀盐酸中和,后用大量水冲洗,再涂上2%~5%的硼酸溶液 | |
| D. | 用四氯化碳萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定存在SO42-、NH4+、Cl- | |
| B. | 原溶液中一定不存在Br-、Fe2+、SO32- | |
| C. | 原溶液中可能存在SO32-、K+ | |
| D. | 原溶液中滴定存在K+,c(K+)≥0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: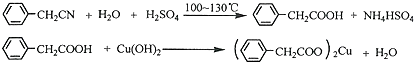
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com