
|
下列反应,属于氧化还原反应的是 | |
A. |
2NaHCO3 |
B. |
KClO3+6HCl(浓) |
C. |
CO2+Ca(OH)2 |
D. |
2KMnO4 |
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
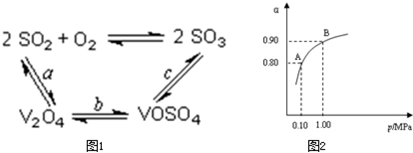
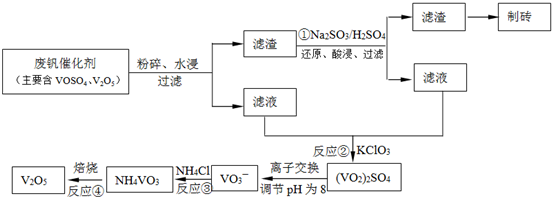
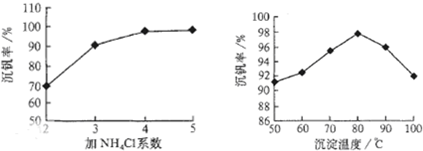
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
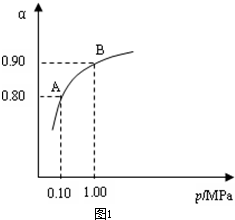 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:| 催化剂 | △ |
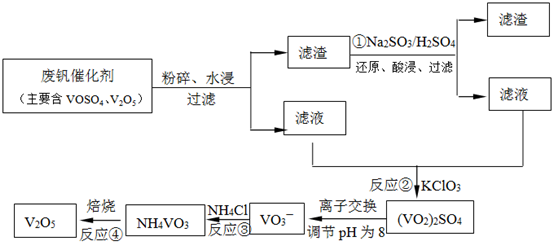
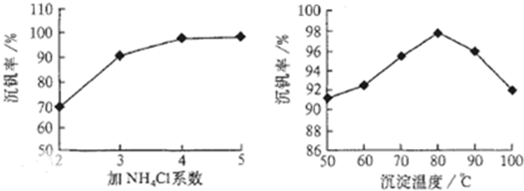
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述反应均属于氧化还原反应 | B、该厂可同时建硫酸厂和炼铁厂 | C、该厂的原料除富铜矿外,还需空气和硅石 | D、反应④转移12e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com