
【题目】下列关于酸、碱、盐元素组成的说法中,正确的是( )
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A. 12ΔH3+5ΔH2-2ΔH1 B. 2ΔH1-5ΔH2-12ΔH3
C. 12ΔH3-5ΔH2-2ΔH1 D. ΔH1-5ΔH2-12ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙。发生反应:
Ⅰ.WO42ˉ(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OHˉ(aq) K1
CaWO4(s)+2OHˉ(aq) K1
已知:反应Ⅰ的平衡常数K1理论值如下表,请回答下列问题:
温度/℃ | 25 | 50 | 90 | 100 |
K1 | 79.96 | 208.06 | 222.88 | 258.05 |
(1)判断反应Ⅰ的△S ______0、△H______0(填“>”、“=”或“<”),在______(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,溶解度均随温度升高而减小。它们在水中存在如下沉淀溶解平衡:
Ⅱ.CaWO4(s)![]() Ca2+(aq) + WO42ˉ(aq) K2
Ca2+(aq) + WO42ˉ(aq) K2
Ⅲ.Ca(OH)2(s)![]() Ca2+(aq) + 2OHˉ(aq) K3
Ca2+(aq) + 2OHˉ(aq) K3
①根据反应Ⅰ~Ⅲ,可推导出K1、K2与K3之间的关系,则K1=______(用K2、K3表示)。
②根据反应Ⅱ,右图为不同温度下CaWO4的沉淀溶解平衡曲线。则T1 ____T2(填“>”“=”或“<”)。T1时,向0.5 molLˉ1钨酸钠的碱性溶液中,加入适量Ca(OH)2,反应达到平衡后WO42ˉ的转化率为60%,此时溶液中c(Ca2+)=_______molLˉ1。(假设反应前后体积不变)

(3)制取钨酸钙时,适时向反应混合液中添加适量的某种酸性物质,有利于提高WO42ˉ的转化率。反应后过滤,再向滤液中通CO2,进一步处理得到Na2CO3。
①在反应混合液中不直接通入CO2,其理由是_____________;
②用平衡移动原理解释添加酸性物质的理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
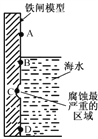
①该电化腐蚀称为_______________,正极反应为________________
②图中A、B、C、D四个区域,生成铁锈最多的是_______(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
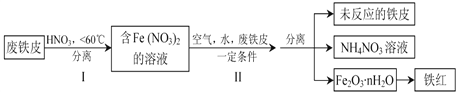
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________
②步骤II中发生反应:4Fe(NO3)2+O2+ (2n +4)H2O=2Fe2O3nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为___________
③上述生产流程中,能体现“绿色化学”思想的是_________________(任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g)![]() Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=________________
②若在1L密闭容器中加人0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠与硫酸反应的气体产物成分及NaNO2性质进行如下探究:

已知:①NO+NO2+2OH-=2NO2-+H2O;
②气体液化的温度:NO2:21℃,NO:152℃。
(1)仪器a的名称是_____________________。
(2)若要验证A中反应生成的气体产物成分且又不能污染环境,仪器的连接顺序为(用字母序号从左→右表示):A、C、______、______、__________。
(3)B中NaOH溶液的作用是_____________________________________。
(4)反应前打开弹簧夹,通入一段时间氮气,其目的是_______________________;关闭弹簧夹,打开分液漏斗活寒,滴入70%硫酸后,A中产生红棕色气体。
(5)①确认A反应产生的气体中含有NO的现象是:_________________________。
②A中反应的化学反应方程式为________________________________。
(6)利用所提供的试剂(NaNO2溶液、KMnO4溶液、KI溶液、稀硫酸、淀粉溶液)设计实验,证明酸性条件下NaNO2具有氧化性________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,如图(Ⅰ)所示:△H1=△H2+△H3 , 根据上述原理和图(Ⅱ)所示,判断各对应的反应热关系中不正确的是( ) 
A.A→F△H=﹣△H6
B.A→D△H=△H1+△H2+△H3
C.△H1+△H2+△H3+△H4+△H5+△H6=0
D.△H1+△H6=△H2+△H3+△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途具有对应关系的是
A.氨气易液化,可用作制冷剂
B.溴化银具有感光性,可用于人工降雨
C.氯化铁具有氧化性,可用了自来水的杀菌消毒
D.氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.在周期表中,主族元素所在的族序数等于原子的最外层电子数
B.电子云表示电子在原子核外运动的轨迹
C.最外层电子数为8的都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com