
 CH3COOH+OH-,消耗了水电离产生的H+,破坏了水的电离平衡,水会继续电离产生的H+又被消耗,最终当达到电离平衡时,c(H+)<c(OH-)。(2)若溶液中只存在溶质CH3COONa,则由于CH3COO-水解消耗,所以 c(Na+)> c(CH3COO-);Na+、CH3COO-都是盐电离产生的,而OH-、H+都是弱电解质水电离产生的。盐的电离远大于水的电离。则c(CH3COO-)>c(OH-)。这与题意不符。说明溶液中还存在其它的电解质。由于c(OH-)>c(CH3COO-),说明还存在碱NaOH。因此该溶液中的溶质为NaOH和CH3COONa。若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则说明溶液显酸性,含有溶质CH3COOH。由于溶液中c(CH3COO-)>c(Na+),则还有溶质CH3COONa。因此该溶液中的溶质为CH3COOH和CH3COONa。(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,若二者的物质的量相等,则溶液显碱性。性质溶液恰好呈中性,则说明混合前n(CH3COOH)>n(NaOH).由于NaOH是强碱,完全电离,而CH3COOH是弱酸,部分电离,混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)>c(H+)。
CH3COOH+OH-,消耗了水电离产生的H+,破坏了水的电离平衡,水会继续电离产生的H+又被消耗,最终当达到电离平衡时,c(H+)<c(OH-)。(2)若溶液中只存在溶质CH3COONa,则由于CH3COO-水解消耗,所以 c(Na+)> c(CH3COO-);Na+、CH3COO-都是盐电离产生的,而OH-、H+都是弱电解质水电离产生的。盐的电离远大于水的电离。则c(CH3COO-)>c(OH-)。这与题意不符。说明溶液中还存在其它的电解质。由于c(OH-)>c(CH3COO-),说明还存在碱NaOH。因此该溶液中的溶质为NaOH和CH3COONa。若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则说明溶液显酸性,含有溶质CH3COOH。由于溶液中c(CH3COO-)>c(Na+),则还有溶质CH3COONa。因此该溶液中的溶质为CH3COOH和CH3COONa。(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,若二者的物质的量相等,则溶液显碱性。性质溶液恰好呈中性,则说明混合前n(CH3COOH)>n(NaOH).由于NaOH是强碱,完全电离,而CH3COOH是弱酸,部分电离,混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)>c(H+)。

 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源:不详 题型:单选题
| A.pH=11的氨水中:c(OH-)=3.0mol·L-1 |
| B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)=c(CH3COO-) |
| C.pH=2的稀盐酸中,c(H+)=c(Cl-) |
| D.pH=8的Na2SO3溶液中,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该酸式盐的水溶液一定显酸性 |
| B.在该盐溶液中,离子浓度为c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
C.若HY-能水解,水解方程式为HY-+H2O Y2-+H3O+ Y2-+H3O+ |
D.若HY-能电离,电离方程式为HY-+H2O Y2-+H3O+ Y2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
 的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。
的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
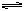 Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )| A.降低温度 | B.加入少量Na2CO3 | C.加入少量盐酸 | D.增加FeCl3的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃时,pH=7的NH4Cl与NH3?H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.25℃时,pH=2的CH3COOH与pH=12的NaOH等体积混合: c(CH3COO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1mol/LNa2CO3溶液:2c(CO32-)+2c(HCO-)+2c(H2CO3)=c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com