
| A. | 酸 | B. | 碱 | C. | 有机物 | D. | 酸性氧化物 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
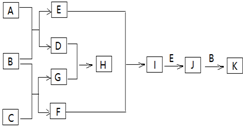 有关物质的转化关系如图所示(部分物质与条件已略去).已知A为淡黄色固体,B为常见的无色液体,C为两种元素组成的化合物,摩尔质量为150g/mol,E为单质气体,F为气态氢化物,有臭鸡蛋气味,G为两性氢氧化物,K为常见的酸.
有关物质的转化关系如图所示(部分物质与条件已略去).已知A为淡黄色固体,B为常见的无色液体,C为两种元素组成的化合物,摩尔质量为150g/mol,E为单质气体,F为气态氢化物,有臭鸡蛋气味,G为两性氢氧化物,K为常见的酸.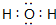 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
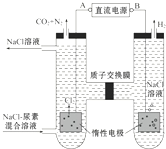
| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是天然气的主要成分 | B. | 不能使稀的酸性高锰酸钾溶液褪色 | ||
| C. | 是一种植物生长调节剂 | D. | 是聚乙烯塑料袋的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
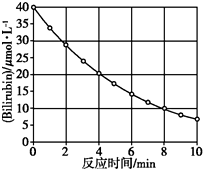 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )| A. | 2.5 μmol/( L•min)和2.0 μmol/L | B. | 2.5 μmol/( L•min)和2.5 μmol/L | ||
| C. | 3.0 μmol/( L•min)和3.0 μmol/L | D. | 5.0 μmol/( L•min)和3.0 μmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用洁淨铂丝蘸取少量待测液在酒精灯火焰上灼烧 | 火焰呈现黄色 | 待测液中只含Na+,不含K+ |
| B | 用铁作电极电解饱和食盐水 | 两极上均产生气体 | 阴、阳极分别生成H2和Cl2 |
| C | 向饱和氯水中加人少量石灰石 | 产生无色气体 | 酸性:HCl0>H2CO3 |
| D | 向Ca(ClO)2溶液中 通入足SO2 | 产生白色沉淀 | Ca(C1O)2具有氧化性,沉淀为CaSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com