
分析 (1)氧化剂中元素的化合价为较高价,还原剂中元素的化合价为较低价;
(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,反应中Fe元素的化合价降低,C元素的化合价升高,3molCO参加反应失去6mol电子;
(3)反应中Cr元素化合价变化为:+6→+3;氯化氢中氯元素化合价变化为:-1→0,依据氧化还原反应得失电子守恒、原子个数守恒书写方程式;
依据方程式1K2Cr2O7+14HCl=2KCl+2CrCl3+3 Cl2+7H2O,生成3mol氯气转移6mol电子,被氧化的氯化氢的物质的量为6mol,据此计算当生成33.6LCl2(标准状况)时,被氧化的HCl的物质的量和转移电子数.
解答 解:(1)①KMnO4、③O2、④Cl2 中所含有中心元素化合价处于高价态,反应中易得到电子,表现为氧化物性,常做氧化剂;
②H2、⑤CO、⑥Al 中所含中心元素化合价处于低价态,反应中容易失去电子,表现为还原性,常做还原剂;
故答案为;①③④; ②⑤⑥;
(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,反应中Fe元素的化合价降低,C元素的化合价升高,3molCO参加反应失去6mol电子,用双线桥表示为: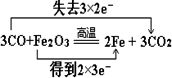 ;
;
故答案为: ;
;
(3)反应中Cr元素化合价变化为:+6→+3;氯化氢中氯元素化合价变化为:-1→0,1molK2Cr2O7参加反应得到6mol电子,生成1mol氯气则有6molHCl失去6mol电子,二者最小公倍数为6,依据得失电子守恒,K2Cr2O7系数为1,氯气系数为3,依据原子个数守恒,KCl系数为2,CrCl3系数为2,依据氯原子个数守恒,HCl系数为14,依据氢原子个数守恒则水分子系数为7,方程式:1K2Cr2O7+14HCl=2KCl+2CrCl3+3 Cl2+7H2O,
33.6LCl2(标准状况)物质的量=$\frac{33.6L}{22.4L/mol}$=1.5mol,依据方程式1K2Cr2O7+14HCl=2KCl+2CrCl3+3 Cl2+7H2O,生成3mol氯气转移6mol电子,被氧化的氯化氢的物质的量为6mol,所以生成1.5mol氯气
被氧化的氯化氢的物质的量为3mol,转移电子数为3mol,个数为3NA;
故答案为:1 14 2 2 3 7;3mol; 3NA;
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,注意从物质所含元素化合价高低判断物质的氧化性与还原性的方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 与电源正极相连的是电解池的阴极 | B. | 与电源负极相连的是电解池的阴极 | ||
| C. | 在电解池的阳极发生的是氧化反应 | D. | 若用铁做阴极,则铁不会被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 碱性氧化物一定是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能
X、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 | |
| B. | 实验室配制FeCl3溶液时,先将FeCl3溶于浓盐酸再加水稀释 | |
| C. | 从海带灰中提取碘时,为了使I-既能完全转化为I2,又对环境无影响,可选H2O2作氧化剂 | |
| D. | 制备硫酸亚铁铵晶体,在蒸发皿中蒸发浓缩溶液时,不能将溶液全部蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N≡N | O=O | N-N | N-H | O-H | |
| 键能(KJ•mol-1) | 946 | 497 | 154 | 391 | 463 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
| 乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |

| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 3.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 3.0 | 0 | 0 |
| B/mol | 0 | 0 | 3.0 | 3.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
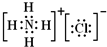 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com