
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 氧原子的结构示意图: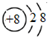 | |
| C. | 过氧化氢的电子式: | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
分析 A.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
B.氧原子的电荷守恒=核外电子总数=8,最外层含有6个电子;
C.过氧化氢为共价化合物,分子中含有1个O-O键和2个O-H键;
D.乙酸甲酯为乙酸和甲醇反应生成的酯.
解答 解:A.质子数为8、中子数为10的氧原子的质量数为18,该原子正确的表示方法为:188O,故A错误;
B.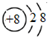 为氧离子结构示意图,氧原子的最外层含有6个电子,其正确的原子结构示意图为:
为氧离子结构示意图,氧原子的最外层含有6个电子,其正确的原子结构示意图为: ,故B错误;
,故B错误;
C.过氧化氢为共价化合物,其电子式为 ,故C正确;
,故C正确;
D.HCOOC2H5为甲酸乙酯,乙酸甲酯正确的结构简式为:CH3COOCH3,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、原子结构示意图、元素符号、结构简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 | |
| B. | 在二氧化硅晶体中,围成最小环的原子数 | |
| C. | 在金刚石晶体中,围成最小环的原子数 | |
| D. | 在CsCl晶体中,与一个Cs+最近的且距离相等的Cs+的个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(D)=0.2mol•L-1•s-1 | ||
| C. | v(C)=0.25mol•L-1•s-1 | D. | v(B)=0.3mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | 饱和食盐水$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{H_{2}O+O_{2}}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
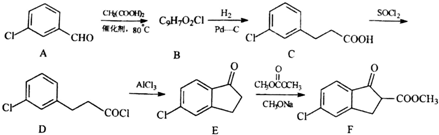
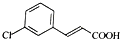 ,由D→E的反应类型是取代反应.
,由D→E的反应类型是取代反应.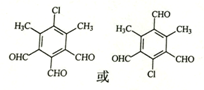 .
.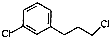 )为原料制备化合物E(
)为原料制备化合物E(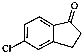 )的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com