
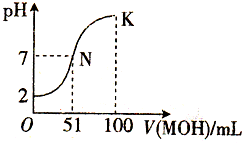
 在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )| A. | MA溶液的pH>7 | B. | K点时加水稀释溶液,c(H+)减小 | ||
| C. | 在N点,c(A-)=c(M+)+c(MOH) | D. | 在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
分析 A.根据0.01mol/L的HA溶液的pH判断HA;N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,据此判断MA溶液的酸碱性;
B.K点溶液呈碱性,稀释过程中氢氧根离子浓度减小,结合水的离子积不变分析氢离子浓度变化;
C.在N点时混合液的pH=7,则c(OH-)=c(H+),根据电荷守恒可知c(A-)=c(M+);
D.K点溶液pH>7,c(OH-)>c(H+),根据电荷守恒判断溶液中各离子浓度大小.
解答 解:A.根据图象可知,0.01mol•L-1HA溶液中pH=2,则HA在溶液中完全电离,则HA为强酸;100mL 0.01mol•L-1HA溶液中加入51mL 0.02mol•L-1MOH溶液时,溶液的pH=7,则加入50mL该MOH溶液时,混合液为酸性,数目MOH为弱碱,则MA为强酸弱碱盐,其溶液呈酸性,MA溶液的pH<7,故A错误;
B.K点溶液呈碱性,稀释后溶液中氢氧根离子浓度减小,由于水的离子积不变,则氢离子浓度增大,故B错误;
C.N点溶液呈中性,则c(OH-)=c(H+),根据电荷守恒c(OH-)+c(OH-)=c(H+)+c(M+)可得,c(A-)=c(M+),故C错误;
D.在K点时混合溶液体积是碱溶液的2倍,溶液pH>7,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒c(OH-)+c(OH-)=c(H+)+c(M+)可得,c(M+)>c(A-),溶液中各离子浓度大小为:c(M+)>c(A-)>c(OH-)>c(H+),故D正确;
故选D.
点评 本题考查了酸碱混合时的定性判断、溶液中离子浓度大小比较,题目难度中等,注意掌握酸碱混合的定性判断方法,需要根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点;要求学生能够根据电荷守恒、盐的水解、物料守恒判断溶液中各离子浓度大小.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5-3 | +7-1 | +6-2 | +3 |
 .
.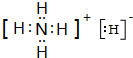 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4 L 气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1 mol N2与足量H2反应生成NH3,有6NA个共价键生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g 30% CH3COOH溶液中含氢原子数为2NA | |
| B. | 标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA | |
| C. | 16gO3和O2混合物中含氢原子数为NA | |
| D. | 精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
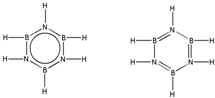 .
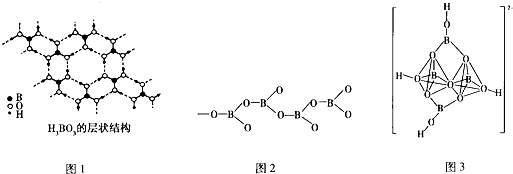
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
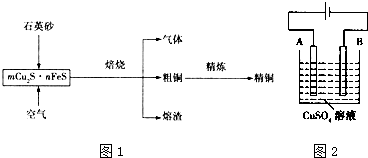
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
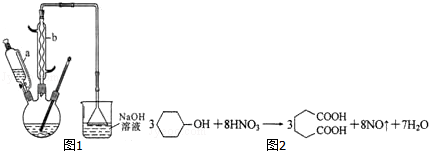
| 物质 | 密度 | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
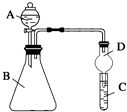 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
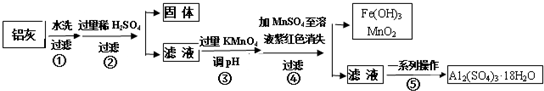
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com