
分析 写出混合液中的电荷守恒c(H+)+c(K+)=2c(C2O42-)+c(OH-)+c(HC2O4-),结合已知关系②c(C2O42-)+2c(OH-)=2c(H+)+c(HC2O4-)+3c(HC2O4),将①×2+②可得:③c(K+)=3[c(C2O42-)+c(HC2O4)+c(HC2O4-)],从而证明K2C2O4和KHC2O4的物质的量相等,所以a=b.
解答 解:amol.L-1的K2C2O4溶液与bmol.L-1的KHC2O4溶液等体积混合,根据电荷守恒可得:①c(H+)+c(K+)=2c(C2O42-)+c(OH-)+c(HC2O4-),已知所得溶液中粒子浓度间的关系为:②c(C2O42-)+2c(OH-)=2c(H+)+c(HC2O4-)+3c(HC2O4),
将①×2+②可得:③c(K+)=3[c(C2O42-)+c(HC2O4)+c(HC2O4-)],
只有当K2C2O4和KHC2O4的物质的量相等时才能满足c(K+)=3[c(C2O42-)+c(HC2O4)+c(HC2O4-)],
所以两溶液中含有K2C2O4和KHC2O4的物质的量相等,又两溶液等体积混合,
所以两溶液的浓度相等,即:a=b,
答:通过以上分析可知,两溶液的浓度一定相等,即a=b.
点评 本题考查了离子浓度大小比较及其综合应用,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
 用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
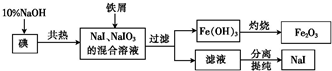
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | AlCl3 | C. | CaCl2 | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 30 | 40 | 50 | 60 |
| NH3生成量/10-6 mol | 4.8 | 5.9 | 6.0 | 6.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4与C4H10互为同系物 | |
| B. | C5H12有三种同分异构体 | |
| C. | 乙烯、乙醇和乙酸都可以使高锰酸钾溶液褪色 | |
| D. | 苯分子中的碳碳键是介于单键和双键之间的独特的键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com